 а)
а) 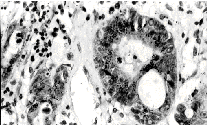 б)
б)
УДК 576.385.5;616-006
Данные современной теоретической онкологии свидетельствуют о том, что инфильтративный рост опухолей и процесс их метастазирования осуществляются за счет последовательного взаимодействия различных биологических механизмов [8]. Cреди последних важное значение придается изменениям в структуре белков межклеточного матрикса опухоли, вследствие чего ее клетки утрачивают адгезивные свойства, а также приобретают способность к миграции и имплантации на отдалении. Так, в строме различных опухолей выявлено замещение белков зрелой соединительной ткани (ламинина, коллагенов и фибронектина) на тенасцин. Последний представляет собой гликопротеин с молекулярной массой 1,900 Кда, состоящий из 6 субъединиц. Молекула тенасцина имеет сложную структуру, поскольку на одной из ее терминалей располагаются лиганды, препятствующие адгезии клеточных мембран, а на другой локализуются белки, обеспечивающие образование межклеточных контактов [4, 8, 9]. Тенасцин синтезируется в различных тканях эмбриона, наиболее интенсивно - в зонах эпителиально-мезенхимальных контактов и в развивающейся нервной ткани. В зрелых тканях небольшие количества тенасцина были обнаружены в веществе сухожилий и хрящей, этот белок экспрессируется также в процессе заживления ран [4, 8].
Изучение иммунореактивности тенасцина в различных опухолях выявило, что она имеет место в новообразованиях легкого, молочной железы, яичников, желудочно-кишечного тракта, меланоцитарных опухолях [2, 4, 5, 10-12]. Стромальная экспрессия тенасцина наблюдалась в опухолях различной степени малигнизации, тогда как цитоплазматическая - только в злокачественных новообразованиях. Среди опухолей центральной нервной системы (ЦНС) иммунореактивность тенасцина была верифицирована в злокачественных глиомах и сосудах нейроцитом [1, 6, 7].
В литературе не представлены данные иммуногистохимического изучения тенасцина в гематогенных метастазах различных опухолей, однако подобное исследование актуально, в первую очередь, потому, что тенасцин рассматривается как возможный промотор метастатического процесса.
Метастазирование в ЦНС наблюдается у 13-24% больных с новообразованиями различной локализации и, как правило, выявляется в терминальной стадии опухолевого заболевания [3, 8]. Поскольку основным методом лечения солитарных интрацеребральных метастазов является их радикальное хирургическое удаление, биоптаты этих опухолей вполне доступны для полноценного иммуногистохимического изучения.
Целью настоящего исследования было изучение иммунореактивности тенасцина в различных метастатических опухолях головного мозга.
Объектом настоящего исследования был материал 83 биопсий метастатических опухолей головного мозга, полученных в НИИ нейрохирургии за период с 1993 по 1996 гг. Среди больных было 56 лиц мужского пола и 27 - женского, возраст больных варьировался от 46 до 73 лет, средний возраст составил 59 лет. У всех больных источники метастазирования были клинически верифицированы; в 35 случаях - рак легкого, в 18 - меланома кожи, в 12 - рак молочной железы, в 12 - рак почки и в 6 - рак желудочно-кишечного тракта (ЖКТ).
Материал биопсий был фиксирован в забуференном 10% формалине и залит в парафин (Histowax, Leica). Иммуногистохимическое исследование было выполнено на серийных срезах толщиной 5 микрон с минимальной площадью 1 см. Срезы инкубировали с формалин-резистентными антителами к тенасцину (DAKO, клон ТN2, рабочее разведение 1:50) на протяжении 18 часов при t +4 оC. Для выявления иммунного окрашивания применялся стрептавидин-биотиновый пероксидазный метод (DAKO LSAB kit), во всех случаях проводилось докрашивание ядер гематоксилином.
Результаты изучения иммунореактивности тенсцина
в различных метастатических опухолях головного мозга были следующими
(табл.).
Таблица
|
| |||
| Легкое | Плоскокле-точный рак | |||
| Легкое | Аденокарци-нома | |||
| Легкое | Мелкокле-точный рак | |||
| Молочная железа | Аденокарци-нома | |||
| Почка | Светлокле-точный рак | |||
| Кожа | Меланома | |||
| Желудочно-кишечный тракт | Аденокарци-нома | |||
| Всего | ||||
Резко выраженная стромальная экспрессия тенасцина была обнаружена
во всех 35 случаях метастатических опухолей легких, однако у разных
гистологических вариантов имелись значительные отличия в распределении
тенасцин-позитивного материала. В 18 случаях метастазирования
плоскоклеточного рака тенасцин-позитивные волокна формировали
крупные септы, разделяющие опухоль на отдельные дольки; в толще
последних выявлялись волокна, тесно связанные с септами и оплетающие
отдельные клетки. В метастазах мелкоклеточного рака [7] и аденокарцином
легкого [10] скоплений тенасцина в виде септ не наблюдалось, его
стромальная экспрессия в этих опухолях была представлена сетью
рыхло расположенных тонких волокон, оплетающих отдельные клетки
и имеющих тесную связь с окрашенными стенками сосудов. Внутриклеточная
экспрессия тенасцина была верифицирована во всех 18 случаях метастазирования
плоскоклеточного рака (рис., а), в 2 случаях метастазирования
мелкоклеточного рака (рис., б) и в 8 случаях метастазирования
аденокарцином (рис., в). В случае плоскоклеточного рака
тенасцин-позитивные клетки обычно распределялись по периферии
долек и контактировали с волокнами септ, в случае мелкоклеточного
рака и аденокарцином подобной ориентации окрашенных клеток не
наблюдалось.
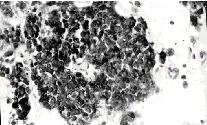
Стромальная экспрессия тенасцина в виде густой сети тонких волокон
была обнаружена во всех 18 случаях метастазирования меланом кожи.
В 9 метастатических меланомах выявлялись также скопления клеток
с диффузной цитоплазматической экспрессией тенасцина (рис., г).
 а)
а)  б)
б)
 в)
в) 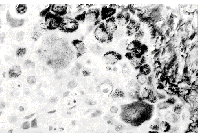 г)
г)
 д)
д)  е)
е)
В 12 случаях метастазирования аденокарцином молочной железы экспрессия тенасцина верифицировалась исключительно в строме опухоли, при этом окрашивались многочисленные тонкие волокна, формирующие крупные междольковые септы (рис. 1, д). Внутри долек и в цитоплазме клеток экспрессия тенасцина не выявлялась.
В 12 случаях метастазирования светлоклеточного рака почки экспрессия тенасцина обнаруживалась в виде интенсивного окрашивания волокон стромы и базальных мембран. В двух опухолях было также верифицировано цитоплазматическое окрашивание отдельных групп клеток.
В 6 случаях метастазирования аденокарцином ЖКТ имела место выраженная внеклеточная экспрессия тенасцина с окрашиванием волокон, базальных мембран и стенок сосудов. Гранулярная цитоплазматическая экспрессия тенасцина выявилась в 3 случаях метастазирования аденокарцином сигмовидной кишки, окрашенные гранулы определялись преимущественно у апикального края клеток (рис. 1, д).
Суммируя полученные данные, можно констатировать, что экспрессия тенасцина в межклеточном веществе имела место у всех интрацеребральных метастазов. Внутрицитоплазматическая экспрессия верифицировалась реже; она была обнаружена в 50% опухолей и имела четкую зависимость от гистогенеза новообразования и локализации первичного очага; чаще она выявлялась в метастазах рака легкого (80%), рака ЖКТ (50%) и меланомах (50%).
В эмбриональных тканях тенасцин синтезируется фибробластами и клетками глии, тогда как в опухолях достоверно определены два возможных механизма его продукции [4, 5, 7, 9-12].
1. Синтез тенасцина фибробластами, которые активированы воздействием факторов роста, продуцируемых опухолевыми клетками. К последним, в частности, относятся трансформирующие факторы роста и . Аналогичный механизм активации фибробластов, по-видимому, имеет место и в процессе репарации раневых повреждений.
2. Тенасцин может синтезироваться непосредственно опухолевыми клетками, однако биологические механизмы, обеспечивающие этот процесс, пока точно не установлены.
По всей вероятности, в интрацеребральных метастатических опухолях осуществляются оба вышеупомянутых механизма продукции тенасцина; при этом можно предположить, что его синтез фибробластами играет важную роль в формировании стромы метастатической опухоли. Внутриклеточная локализация тенасцина предполагает также возможность его синтеза непосредственно в опухолевых клетках.
Биологическое и прогностическое значение экспрессии тенасцина в опухолях оценивается неоднозначно. Часть исследователей считает, что тенасцин способствует инвазивному росту опухолей и активизирует метастатические процессы [4-7, 9, 11], тогда как другие отмечают, что экспрессия тенасцина в строме опухолей может препятствовать их распространению в окружающие ткани и нередко является прогностически благоприятным фактором [2, 10, 12]. Кроме того, высказывается точка зрения о том, что экспрессия тенасцина в зонах имплантации отщепленных опухолевых клеток способствует их адгезии с субстратом и значительно облегчает процесс проникновения в его толщу [4, 11].
Внеклеточная экспрессия тенасцина была обнаружена нами в подавляющем большинстве метастатических опухолей головного мозга. Поскольку тенасцин не синтезируется в зрелой нервной ткани, его наличие в строме метастатических опухолей можно объяснить следующим образом.
1. Не исключено, что в процессе формирования метастазов активное участие принимают не только опухолевые клетки, т. е. паренхиматозный компонент, но и элементы стромы опухоли. Вполне вероятно, что рост метастатического очага может происходить как за счет активной пролиферации опухолевых клеток, так и вследствие увеличения его стромального компонента. Синтез тенасцина в метастазах может осуществляться активированными фибробластами, которые мигрировали из первичного очага вместе с опухолевыми клетками.
2. Формирование стромы метастатической опухоли и синтез в ней тенасцина могут осуществляться за счет пролиферации фибробластов стенок сосудов головного мозга. Последние, вероятно, активированы воздействием трансформирующих факторов, которые либо синтезируются в имплантированных опухолевых клетках, либо аккумулируются в ткани мозга в ответ на опухолевую инвазию.
Согласно литературным данным, внутриклеточная экспрессия тенасцина присутствует в раках легкого, молочной железы, желудочно-кишечного тракта и в меланомах [2, 4, 5, 9-12]. Выявленная нами цитоплазматическая экспрессия тенасцина в метастатических опухолях головного мозга имела некоторые отличия от новообразований первич-ной локализации.
Среди метастазов рака легкого число опухолей с цитоплазматической концентрацией тенасцина было значительно большим. Согласно данным Soini et al. [11], которые изучали иммунореактивность тенасцина в опухолях легкого, его внутриклеточная экспрессия имела место в 10 из 27 плоскоклеточных раков, в 2 из 27 аденокарцином и не выявлялась ни в одном из 6 мелкоклеточных раков. Согласно нашим данным, среди метастазов рака легкого клетки с экспрессией тенасцина в цитоплазме имели место во всех 18 (100%) метастазах плоскоклеточного рака, в 8 из 10 (80%) метастазов аденокарцином и в 2 из 7 (29%) метастазов мелкоклеточного рака. Вышеизложенным фактам можно дать следующее объяснение. С одной стороны, вполне возможно, что в раках легкого наибольшей метастатической активностью и способностью формировать интрацеребральные метастазы обладают клоны тенасцин-позитивных клеток. С другой стороны, не исключено, что клетки интрацеребральных метастазов рака легкого приобретают в новых условиях существования способность синтезировать тенасцин; этим можно отчасти объяснить появление клона тенасцин-позитивных клеток в метастазах мелкоклеточного рака легкого. Приобретение клетками подобных свойств может быть обусловлено или стимуляцией факторами роста, которые в избытке содержатся в нервной ткани, или же появлением дополнительных повреждений в их генетическом аппарате.
Yoshida et al. [12] обнаружили внутриклеточную экспрессию тенасцина в составе аденокарцином молочной железы и выявили также, что при ее отсутствии 5-летняя выживаемость больных была значительно ниже. В метастатических аденокарциномах молочной железы цитоплазматическая концентрация тенасцина полностью отсутствовала; и это позволяет высказать предположение о том, что в этих опухолях тенасцин-негативные клоны клеток способны формировать интрацеребральные метастазы.
Полученные данные демонстрируют, что взаимосвязь между цитоплазматической экспрессией тенасцина и метастазированием опухолей имеет гисто- и органоспецифический характер. Анализ особенностей экспрессии тенасцина в других разновидностях интрацеребральных метастатических опухолей (например, при светлоклеточном раке, аденокарциномах различной локализации) на данном этапе исследования затруднен ввиду малого количества наблюдений и немногочисленности литературных данных, посвященных иммунореактивности тенасцина в первичных опухолях.
Резюмируя полученные данные, можно отметить, что перспективным исследованием для более четкого определения места и роли тенасцина в процессе метастазирования различных новообразований было бы одновременное изучение этого протеина в первичной и метастатической опухолях у одного и того же больного.
С другой стороны, полученные данные обосновывают целесообразность использования векторной лучевой терапии с антителами к тенасцину для консервативного лечения иноперабельных метастатических опухолей головного мозга, включая множественные метастазы, канцероматоз мозговых оболочек и т. д. Предварительные результаты этого метода лучевой терапии уже опубликованы в литературе [8], однако он требует дальнейшего теоретического и клинического анализа.
Таким образом, иммуногистохимическое исследование
тенасцина в 83 метастатических опухолях головного мозга выявило
наличие стромальной экспрессии во всех наблюдениях, а цитоплазматической
экспрессии - в 50% наблюдений. Наиболее часто цитоплазматическая
экспрессия тенасцина выявлялась в метастазах рака легкого, ЖКТ
и меланом кожи и полностью отсутствовала в метастазах аденокарцином
молочной железы. Полученные данные свидетельствуют о возможности
синтеза тенасцина в строме и паренхиме метастатических опухолей
ЦНС и позволяют высказать предположение о неоднозначности его
роли в цепи биологических механизмов, осуществляющих формирование
интрацеребральных метастазов.
1. Коршунов А.Г., Сычева Р.В. // Архив патологии.- 1997, ¦ 1.- C. 51-57.
2. Broll R., Meyer S., Neurber M., Bruch H.P. // Gen. Diagn. Pathol.- 1995.- Vol. 141.- P. 111-119.
3. Burger P.C., Scheithauer B.W. Atlas of Tumor Pathology: Tumors of the Central Nervous System. Armed Forces Institute of Pathology.- Wachington, 1994.
4. Chiquet-Ehrismann R., Kalla P., Pearson C.A. // Cancer Res. - 1989.- Vol. 49.- P. 4322-4325.
5. Hauptmann S., Zardi L., Siri A. et al. // Lab. Inest.- 1995.- Vol. 73.- P. 172-182.
6. Higuchi M., Ohnishi T., Arita N. et al. // Acta Neuropathol.- Vol. 85.- P. 481-487.
7. Higuchi M., Arita N., Ohnishi T. et al. // Clin. Neuropathol.- 1995.- Vol. 14.- P. 221-227.
8. Levine A.I., Schmidek H.H. Molecular genetics of nervous system tumors.- New-York, Wiley-Liss., 1993.
9. Lightner V.A., Erickson H.P. // I. Cell Science.- 1990.- Vol. 95.- P. 263-277.
10. Sakakura N., Kusakabe M. // Perspect. Dev. Neurobiol.- 1994.- Vol. 2.- P. 111-116.
11. Soini Y., Paakko P., Nuorva K.et al. // Am. I. Clin. Pathol.- 1993.- Vol. 100.- P. 145-150.
12. Yoshida T., Ishihara A., Hirokawa Y. et al.
// Cancel Lett.- 1995.- Vol. 90.- P. 65-73.
Immunohistochemical study of tenascin in 83 cerebral
metostatic tumors revealed stromal expression in all examinations,
but cytoplasmic one was found only in 50%. Most frequently the
cytoplasmic expression of tenascin took place in metastasis of
caancer of lungs and gastrointestinal tract and skin melanoma.
Obtained data corroborate the possibility of tenascin synthesis
within stroma and parenchyma of CNS metastatic tumors and suggest
its specific place in the chain of biomechanisms being involved
in intracerebral metastasis formation.