
УДК 617.5-089.844
300053, Тула, ул. Яблочкова, 1-а, ообъединение
Тульская областная больница; тел.: (0872) 48-49-60,
48-60-70, 48-56-41; факс: (0872) 48-65-04; E-mail: root@ivc.phtula.mednet.com
В настоящее время основной задачей комбустиологии является скорейшее восстановление кожного покрова у тяжелообожженных на больших площадях ожоговых ран. Для этого предлагают использовать сетчатые аутотрансплантаты с большими коэффициентами растяжения (1:6, 1:20) на фоне мощной инфузионно-трансфузионной терапии и общего медикаментозного лечения с применением антибиотиков [1, 2]. Но часто этого бывает недостаточно, возникают нарушения гомеостаза, вызывающие такие грозные осложнения, как сепсис, септическая пневмония, кровотечение из острых и хронических язв различных отделов желудочно-кишеч-ного тракта (ЖКТ), почечная и печеночная недостаточность. Основной причиной осложнений является выключение больших площадей кожи как органа и медленная эпителизация ячеек пересаженных сетчатых трансплантатов аутокожи с широкой сеткой. Вместе с тем, при пластике сетчатыми трансплантатами с большим коэффициентом растяжения через ячейки в сетке происходит дальнейшая потеря жидкости, белка, электролитов, тепла и энергии, происходит инфицирование ран. Для устранения указанных недостатков мы, как и многие другие авторы, пытались внедрить комбинированную пластику, прикрывая сетчатый аутотрансплантат ксено-, алло-, гетерокожей, амниотической оболочкой, тканевым имитатором кожи [1, 3, 4, 5, 6, 7, 8], однако при подобной комбинации утрачивается дренажная функция, что нередко приводит к отслойке и расплавлению сетчатого трансплантата.
В последние годы в ведущих ожоговых центрах мира предприняты попытки восстановления кожного покрова на больших площадях ожоговых ран пересадкой пластов эпидермальных аутоклеток, культивированных на питательных средах. Этому предшествовали экспериментальные исследования [9], авторам которых в 1950 году удалось с помощью энзиматических ферментов разделить полнослойный пласт кожи на отдельные клетки, что, в свою очередь, позволило Каrasek M. [10] в 1960 году вырастить на искусственной питательной среде кератиноциты. H.J. Igel и A.E. Freeman [11] разработали в эксперименте способ закрытия больших раневых поверхностей аутокожей, полученной путем органного культивирования. А в 1981 году OCon-nor и др. [13] была выполнена первая успешная трансплантация культивированных кератиноцитов двум обожженным. Несмотря на успехи и перспективность метода при лечении больных с тяжелыми ожогами, его высокая стоимость, длительные сроки получения аутолоскутов мешают внедрению метода в широкую клиническую практику.
Кроме этого, было выявлено, что в отдаленный период наблюдалась нестойкость эпителиального покрова у больных, так как любое, даже минимальное, механическое воздействие вызывало их повреждение [14]. Чтобы преодолеть это и добиться лучших функциональных результатов пересадки клеточной культуры кератиноцитов, предприняты попытки комбинации различных методик: Ж.-М.Рив [15] закрывал рану после ранней некрэктомии гомокожей, одновременно с этим участок эпителия больного отправляли в Бостон для изготовления пластов кератиноцитов, а после подготовки пласта кератиноцитов, эпителиальный слой гомокожи снимался дерматомом, дерма оставалась на ране и на нее накладывались аутоэпителиальные пластинки.
В отделении патологической анатомии и центре термических поражений института хирургии им. А. В. Вишневского РАМН [16] уже несколько лет подробно изучаются процессы, протекающие в ранах. Разработано принципиально новое направление в лечении больших площадей ожоговых ран с использованием клеточной культуры фибробластов с добавочным прикрытием их сетчатым аутотрансплантатами с большим коэффициентом пластики.
С 1994 года в ожоговом отделении Тульской областной больницы применяется пластика ожоговых ран с использованием культивированных фибробластов человека.
Основу исследования составили результаты обследования и лечения 16 обожженных (табл. 1), из которых было трое детей возраста до шести лет, одна больная в возрасте свыше 60 лет; основную группу из 12 больных составили лица от 20 до 57 лет. Общая площадь термического поражения составляла от 10 до 45% поверхности тела; площадь глубокого ожога - до 10% поверхности тела - была у 1-го больного, ожог 10...20% поверхности тела - у 7 больных и свыше 20% - у 6-х больных. У 2-х больных были обширные пограничные ожоги III-а степени на площади до 30% поверхности тела.
Контрольную группу составили 15 больных с идентичными по тяжести и площади ожогами.
Культуру аллофибробластов получали в лаборатории института, доставляли в Тульскую областную больницу, где в тот же день производилась трансплантация культур клеток на гранулирующие раны. Трансплантацию на рану проводили на синтетических мембранных основаниях с последующей фиксацией их парафинированной отечественной марлей или марлей Дженолет. Через 2 дня проводилась пластика ожоговых ран сетчатыми аутотрансплантатами с коэффициентами пластики 1:4 у детей и 1:6 у взрослых.
Примечание: в скобках - данные контрольной группы
Эффективность лечения оценивали в динамике визуально при перевязках,
по гистологическому исследованию биопсийного материала, по уровню
веществ низкой и средней молекулярной массы (ВНСММ) и уровню олигопептидов
в плазме и на эритроцитах; по индексу токсемии в плазме и на эритроцитах
и суммарному индексу интоксикации [17], по эффективной концентрации
альбумина и связывающей способности плазмы [18]; по уровню лейкоцитарного
индекса интоксикации (ЛИИ) [19]; по содержанию гуморального и
клеточного иммунитета в крови обожженных.
При ожогах III-а степени полная эпителизация ран заканчивалась
на 8 сутки после пересадки клеточной культуры фибробластов.
При глубоких ожогах, в группе с пересадкой фибробластов, эпителизация
в ячейках трансплантата с коэффициентом пластики 1:6 начинается
на вторые сутки. Перемычки сетчатого трансплантата погружались
в грануляционную ткань раны, покрытую фибробластами, при этом
увеличивалась площадь плазматического питания за счет боковых
насечек, в то время как без пересадки фибробластов на вторые сутки
перемычки возвышались над грануляционной тканью, а погружение
происходило на 4-7 сутки.
На 8-е сутки пограничные ожоги, в основном, эпителизировались
полностью, а площадь ячеек сетчатого трансплантата эпителизировалась
на 50%.
На 10-е сутки определялась практически полная эпителизация в группе
с пересадкой фибробластов, в то время как в контрольной группе
определялась лишь краевая эпителизация, при этом от 30 до 50%
пересаженных лоскутов лизировалось.
При гистологическом исследовании в группе больных с использованием
фибробластов наблюдалось качественное отличие вновь образовавшегося
эпителия от контрольного: на 3-и сутки в препаратах наблюдалась
молодая грануляционная ткань с обильной лимфолейкоцитарной инфильтрацией
и единичными тучными клетками; поверхность грануляций покрывали
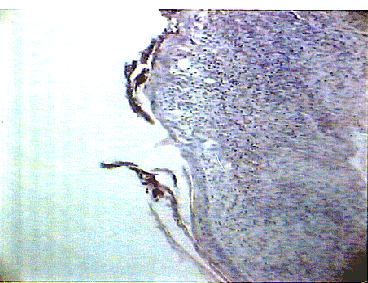
пролиферирующие фибробласты (рис. 1), на 5-е сутки в ростковой
зоне рядом с аутолоскутом наблюдался 3-х слойный эпителий с нечеткой
дифференциацией слоев (рис. 2); в подлежащих тканях - очаговый
отек, обильная лимфоплазмоцитарная инфильтрация с примесью лейкоцитов,
небольшое количество вновь образованных капилляров, а уже к одиннадцатым
суткам отмечалась четкая дифференциация эпидермиса на слои, появлялись
акантотические тяжи, дифференциация дермы была еще нечеткой, но
уже начинал определяться сосочковый слой, а на месте сетчатого
слоя наблюдалась пролиферация фибробластов (рис. 3).
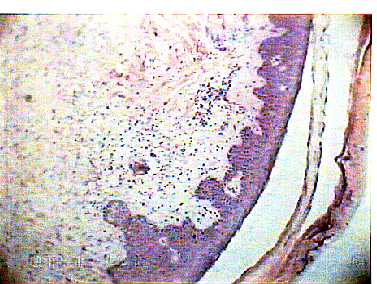
В группе без пересадки фибробластов даже на 20 сутки после аутопластики
определялся истонченный эпидермис без акантотических тяжей и дифференциации
на слои, с обильной лимфолейкоцитарной инфильтрацией дермы
(рис. 4).


Активизация эпителизации под действием культуры фибробластов приводила не только к клиническому улучшению, но и к сдвигам, по сравнению с контролем, показателей гуморального и клеточного иммунитета.
Уровни гуморального и клеточного иммунитета в динамике представлены в табл. 2.
На показатели иммунитета влияет множество факторов [20, 21], которые зачастую не зависят от проводимой терапии, поэтому делать окончательные выводы на нашем достаточно ограниченном материале нельзя, но общие тенденции проследить можно: как видно из таблицы, влияние на гуморальный иммунитет в течение 6 суток было минимальным и связано, по нашему мнению, с общим стабилизирующим воздействием на внутреннюю среду организма удачной пересадки аутокожи на большой площади.
Влияние на клеточный иммунитет было более выраженным. В группе больных с использованием культуры фибробластов на 2-6 сутки после аутопластики происходило (в сравнении с контрольной группой больных) достоверное уменьшение процентного содержания и абсолютного числа лимфоцитов, увеличение процентного содержания и абсолютного числа Т-активных лимфоцитов и В-лимфоцитов, резкое снижение процентного содержания и абсолютного числа нулевых лимфоцитов (табл. 2).
На 7-15 сутки после аутопластики динамика изменений иммуноглобулинов была более показательна, и если в группе без фибробластов наблюдалось повышение иммуноглобулинов А и G, что коррелировало с воспалительной реакцией при лизисе части лоскутов, то в группе с пересадкой фибробластов наблюдалось повышение иммуноглобулинов М, что связано, по нашему мнению, с реакцией антиген - антитело.
| Лимфоциты в% | |||||
| Лимфоциты в тыс. | |||||
| Фагоцитоз в % | |||||
| ЦИК в % | |||||
| Активность комп. в ед. | |||||
| Т-лимфоциты в % | |||||
| Т-лимфоциты в тыс. |
|
|
|
|
|
| Т-активные лимфоциты в % |
|
|
|
|
|
| Т-активные лимфоциты в тыс. |
|
|
|
|
|
| В-лимфоциты в % | |||||
| В-лимфоциты в тыс. |
|
|
|
|
|
| О-лимфоциты в % | |||||
| О-лимфоциты в тыс. |
|
|
|
|
|
| Иммуноглобулины: А |
|
|
|
|
|
| Иммуноглобулины: G |
|
|
|
|
|
| Иммуноглобулины: М |
|
|
|
|
|
| Тн (с теофилином) | |||||
| Тс (с теофилином) | |||||
Примечание: достоверность разницы между вариационными рядами
см. по тексту
Таблица 3
| ВНСММ в плазме (усл.ед.) | ||||||
| ВНСММ на эрит-роцитах (усл.ед.) | ||||||
| олигопепт. в плазме (усл.ед.) | ||||||
| олигопепт. на эритроц. (усл.ед.) | ||||||
| инд. токсем. в плазме (усл.ед.) | ||||||
| инд. токсем. в эритроц. (усл.ед.) | ||||||
| индекс интоксикации (усл.ед.) | ||||||
| ЭКА (г/л) | ||||||
| ССП (%) | ||||||
Примечание:
1. P1 - достоверность разницы между I и II группами
Клеточный иммунитет в группе с пересадкой фибробластов, в основном,
нормализовался, но вызывает удивление практически одинаковое повышение
на 7-15 сутки в обеих группах О-лимфоцитов как в процентном отношении,
так и в абсолютных цифрах.
Особенно сильное влияние комбинированная пластика оказывала
на тест эндогенной интоксикации (табл. 3).
Как видно из табл. 3, уже на 5-10 сутки снижалось содержание
ВСНММ в плазме и на эритроцитах; резко, почти в 2 раза, по сравнению
с контрольной группой, снижалось содержание олигопептидов в плазме.
На эритроцитах в контрольной группе содержание олигопептидов снижалось
еще больше, что и определяло низкий (более чем в 3 раза ниже,
чем в контрольной группе) индекс токсемии в плазме и практически
одинаковый индекс токсемии на эритроцитах. Индекс интоксикации
в контрольной группе оставался на уровне дооперационного, а в
группе с пересадкой фибробластов - более чем на 10 условных единиц
ниже. Это определяло более высокую эффективную концентрацию альбумина
и увеличивало связывающую способность плазмы.
Кроме этого в группе с пересадкой фибробластов на 2-5 сутки происходила
стабилизация лейкоцитарного индекса интоксикации на низких цифрах,
а в контрольной группе он оставался высоким и к 10-м суткам был
выше исходного почти в три раза (табл. 4).
2. P2 - достоверность разницы между I и III группами
3. P3 - достоверность разницы между II и III группами
Таблица 4
| 9,55
0,03 | 3,47
0,16 | 5,25
0,03 | 0,43
0,02 | 5,95
0,03 | 5,28
0,51 | 5,35
0,22 | 0,39
0,05 | 10,05
1,28 | 7,34
1,91 |
Примечание:
1. L - Лейкоциты в тыс.
Комбинированная пластика с использованием культивированных фибробластов
во всех случаях исключала развитие аллергических реакций, хорошо
переносилась пациентами, ускоряла репаративные процессы в ране
и краевую эпителизацию в сетчатом трансплантате, уменьшала боли
при перевязках. Снижался расход трансфузионных сред, приводя,
в конечном счете, к экономическому эффекту при лечении тяжелообожженных.
Кожный покров, восстановленный сетчатыми аутотрансплантатами с
использованием культивированных фибробластов, в отдаленные сроки
в значительной степени утрачивал сетчатый рисунок и косметически
выглядел намного лучше, чем кожный покров, восстановленный сетчатыми
трансплантатами в чистом виде.
Обусловливая быструю эпителизацию ожоговых ран даже при критических
ожогах, значительно уменьшая вероятность развития опасных для
жизни осложнений ожоговой болезни, метод восстановления кожного
покрова с использованием фибробластов сокращал сроки пребывания
в стационаре с 87,46,7 до 54,63,2 дней, улучшал функциональные
и косметические результаты лечения.
Методическая простота, умеренная цена, безопасность транспортировки
на большие расстояния - все это дает широкие возможности
для внедрения метода в практическое здравоохранение страны.
2. ЛИИ - лейкоцитарный индекс интоксикации, рассчитанный по формуле Кальф-Калифа.
3. P1 - разница между I и II группами: 0,01.
4. P2 - разница между I и III группами: 0,01.
5. P3 - разница между II и III группами: 0,05.
6. P4 - разница между I и IV группами: 0,05.
7. P5 - разница между I и V группами: 0,05.
8. P6- разница между IVи V группами: 0,01.
1. При комбинированной кожной пластике с применением клеточной культуры фибробластов визуально эпителизация в ячейках сетчатого трансплантата начиналась на 2-е сутки и опережала во времени эпителизацию в аутотрансплантате без использования фибробластов. Стимулируя регенеративные процессы в гранулирующей ране, клеточная культура фибробластов способствовала более быстрому погружению перемычек сетчатого трансплантата в грануляционную ткань, тем самым увеличивая площадь плазматического питания за счет боковых насечек, что способствовало лучшему приживлению свободного трансплантата.
2. Гистоморфологические исследования показали, что при комбинированной пластике с использованием культуры фибробластов уже на 5-е сутки начиналась, а на 11-е сутки четко определялась дифференциация эпидермиса на слои и начиналась дифференциация дермы; в контрольной группе больных подобная дифференциация не определялась даже к концу третьей недели.
3. Как показали иммунологические исследования, обладая сниженными антигенными свойствами, клеточная культура фибробластов не вызывает сенсибилизирующего эффекта, а ее положительный иммуномодулирующий эффект объясняется высокими регенеративными способностями, обеспечивающими более быструю эпителизацию ожоговых ран в сравнении с контрольной группой.
4. При использовании комбинированной пластики с клеточной культурой фибробластов степень эндогенной интоксикации (ВНСММ и олигопептиды в плазме, индекс токсемии в плазме и общий индекс интоксикации) уже на 5-10 сутки была достоверно ниже, чем в контрольной группе больных.
5. Метод восстановления кожного покрова с использованием
культуры фибробластов, обусловливая быструю эпителизацию ожоговых
ран, сокращает сроки пребывания в стационаре, улучшает функциональные
и косметические результаты пластики.
1. Bohmert H. et al. Hautersatz bei Verbrennungen mit Spalhautnetztrransplantaten und Xenotranspiantaten. B.; Heidelberg; N. Y. 1974. 94 S.
2. Вихриев Б.С. Перспективы дальнейшего улучшения помощи обожженным. Вестник хирургии. 1986. ¦ 5. С. 89-91.
3. Матчин Е.Н. Активная хирургическая тактика при лечении глубоких ожогов в условиях Донской городской больницы Тульской области: Автореф. дис. ... канд. мед. наук.- Рязань, 1975.- 17 с.
4. Kiene S., Schill H., Rower J., Frick U. Lyophilisierte Schweinespalthant als biologischer Wundverband. Zbl. Chir. 1976. Bd 101. ¦ 24. S. 1481-1494.
5. Levin N.S., Lindberg R.A., Salisbury R.A., Mason A.D., Pruitt B.A. Comparison of coarse mesh ganze with biological dressings on granulating wonnds. Am. J. Surg., 1976. 131 6. Р. 727-729.
6. Harris N.S., Compton J.B., Abstan S., Larson D.L. Comparison of Fresh, Frozen and Lyophilized Poreine Skin as Xenografts on Burned Patients. Burns, 1976. 2 ¦ 2. Р. 71-75.
7. Berry R.B. Hackett M.E.J. A comparative evalnation of lyophilized homograft. Lyophilized pigskin and frozen pigskin biological dressings. Burns, 1980. 7 ¦ 2. Р. 84-89.
8. Salisbury R.E., Carnes R.W., Enterline D. Biological dressings and evaporative water loss from burn wonnds. Ann. plast. surg. 1980. 5 ¦ 4 Р. 270-272.
9. Billingham R. E., Medawar P. Technique of free skin grafting in mammals. J. Exp. Bio., 1950, 28, P. 385-402.
10. Karasek M., In vitro culture of human skin epithelial cell. J. Invest. Dermatol., 1966., ¦ 47. P. 533-540.
11. Igel H.J., Freeman A. E., Boeckman C. K., Kleinfeld K. L. A new method for cjvering large surface area wounds with autografts. II. Surgical application of tissue culture extended rabbit-skin autografts. Arch. Surg. 1974. V. 108, ¦ 5. P. 724-729.
12. Freeman A. E., Igel H. J., Waldman N. L., Lisicoff A. M. A new method for covering large area wounds with autografts I in vitro multiplication of rabbit-skin epithelial cells. Arch. Surg. 1974. V. 108, ¦ 5. P. 721-723.
13. OConnor N. E., Mulliken J. B., Banks-Schlegel S., Kehinde O., Green H. Grafting of burns with cultured epithelium prepared from autologous epidermal cells. Lancet. 1981, ¦ 1. P. 75-78.
14. Loring W. Rue, III, MD, William G. Cioffi, MD, William F. McManus, MD, and Basil A. Pruitt, Jr, MD. Wound closure and outcome in extensively burned patients treated with cultured autologous keratinocytes. The Journal of Trauma. 1993, V. 34, ¦ 5 P. 662-668.
15. Ж.-М.Рив // Доклад на международном симпозиуме.- Тула, 1996.
16. Саркисов Д.С. с соавт. Аллотрансплантация культивированных фибробластов на незаживающие раны после аутодермопластики // Бюллетень эксериментальной биологии и медицины. 1991. ¦ 5. С. 77-81.
17. Малахова М.А. Метод регистрации эндогенной интоксикации: Пособие для врачей. Санкт-Петербург: Издательство С.-Петербургской медицинской академии после дипломного образования, 1995. 34 с.
18. Миллер Ю.И., Добрецов Г.Е. Определение эффективной концентрации альбумина в крови // Флуоресцентные методы исследования и клинической диагностики (сборник). Рига, 1991. С. 5-18.
19. Кальф-Калиф Я.Я. О лейкоцитарном индексе интоксикации и его практическом значении // Врачебное дело.- 1941.- ¦ 1.- С. 31-35.
20. Лебедев К.А., Понякина И.Д. Иммунограмма в клинической практике. М.: Наука, 1990. 224 с.
21. Долгушин И.И. с соавторами. Иммунология
травмы. Свердловск: Уральский университет, 1989. 20 с.
In the article there are presented the results of using the latest method of burn treatment in Tula Regional Hospital, i. e., combined autodermatoplasty using allofibroblast culture cultivated in vitro.
The authors have analyzed the dynamics of skin regeneration comparing the results obtained by using reticular transplant (in accordance with routine methods for treatment of gravely burned patients) and combined plasty by means of allofibroblast culture. The analysis and estimation of a treatment efficiency were carried out on the base of visual examination during bind-ups; hystologic assay of bioptic materials; level of the compounds with low- and mid-molecular mass in plasma and at erythrocytes; toxemia index ibid; total index of intoxication; effective concentration of albumin and plasma binding power content of humoral and cellular immunity in the patient's blood.
The results obtained confirm higher efficiency of
the combined plasty using cultivated allofibroblasts in comparison
with the routine teatment methods.