УДК 612.822.3
Прошло уже более 20-ти лет с момента опубликования последней работы П.К.Анохина LСистемный анализ интегративной деятельности нейрона¦ - работы, в которой впервые были сформулированы основные положения принципиально нового подхода к исследованию межнейронных соотношений [1]. Согласно развиваемым представлениям решающее значение в реализации механизмов синаптического взаимодействия в центральной нервной системе (ЦНС) человека и животных принадлежит процессам, которые развертываются не только на уровне межклеточных контактов, но и в центральных структурах нервной клетки. Именно здесь, по мнению П.К.Анохина, индуцируется особый комплекс биохимических реакций, которые, сохраняя строгую специфичность в отношении вызывающих их нейромедиаторных посылок, детерминируют в ходе взаимодействия друг с другом определенный паттерн разрядной активности постсинаптического нейрона.
Это теоретическое предположение в настоящее время в полной мере подтверждается результатами многочисленных экспериментальных исследований [2]. Вместе с тем, полученные за последние годы данные не только доказывают обоснованность сделанных П.К.Анохиным выводов, но и приводят к постановке целого ряда совершенно новых вопросов. В первую очередь это касается проблемы состава нейромедиаторных влияний, которые способны инициировать в протоплазме постсинаптического нейрона распространяющиеся в его центральные структуры (микротубулярным путем) вторичные биохимические процессы. Является ли возникновение последних результатом только разрядной деятельности пресинаптических клеток? Или же определенную роль в их инициации играют и подпороговые явления, связанные с постоянно идущим на уровне каждой синаптосомы спонтанным квантовым высвобождением молекул нейромедиатора?
Последний вопрос приобретает особое значение в свете данных, которые свидетельствуют, что частота квантовой синаптической Lутечки¦ существенным образом зависит от определенных параметров метаболической клеточной активности [3-5], а, значит, паттерн подпороговых нейромедиаторных влияний несет вполне конкретную информационную нагрузку о текущем функциональном состоянии каждой из пресинаптических клеток, включая и так называемые Lмолчащие¦ нейроны.
Цель настоящей работы - рассмотреть один из
аспектов этого круга вопросов, а именно установить количественные
характеристики, отражающие особенности влияния Lподпороговых¦
импульсных подведений ацетилхолинхлорида (АЦХ) на реализацию
специализированной функции нервных клеток.
Для решения поставленной задачи проводили исследование биоэлектрической активности идентифицированных нейронов ППа4 правого париетального ганглия полуинтактного препарата ЦНС виноградной улитки Helix Lucorum в условиях прямого локального кратковременного подведения АЦХ. В экспериментах применяли быстродействующие микроаппликаторы специальной конструкции, позволяющие осуществлять локальное (зона выхода вещества менее 30 мкм), кратковременное (T = 10 мс) хемовоздействие с последующей интенсивной отмывкой препарата в области подведения.
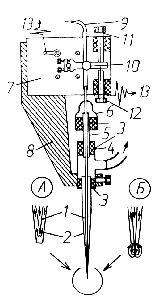
Микроаппликатор (рис. 1) включает в себя коаксиально расположенные по отношению друг к другу стеклянный микрокапилляр 1 (диаметр его стволовой части - 1,2 мм, на конце - 7 мкм) и стеклянную микропипетку 2 (5 мм, 30 мкм), которая зафиксирована с помощью силиконового уплотнителя 3 внутри тройника 4. Подвижный микрокапилляр 1 помещен в отрезок инъекционной иглы 5, в верхней части которой находится резиновый колпачок 6. Для герметизации механических соединений здесь также используются силиконовые уплотнители соответствующего диаметра. Вся эта конструкция вместе с координатным гальванометром 7 закреплена в держателе 8, который установлен на штанге позиционера, обеспечивающего точные микроперемещения устройства в области локализации исследуемой клетки. Подача раствора биологически активных веществ осуществляется под давлением +0,6 атм через полиэтиленовый катетер 9 (LKB ID 0,85 мм), плотно надетый на микрокапилляр 1 и зафиксированный винтом 10 на осевой площадке сельсина 7. Соответственно, удаление жидкости из объема микропипетки 2 производится через боковой канал тройника 4, который подсоединен к насосу отрицательного давления (-0,2 атм). Исходное положение микрокапилляра 1 по отношению к микропипетке 2, а также амплитуда его перемещения регулируются двумя ограничительными микрометрическими винтами 11 и 12. Они же используются в качестве контактов, которые при помощи электрических проводников 13 включены в одну из цепей определения скорости срабатывания прибора.

Подробное описание в тексте
Устройство работает следующим образом. В исходном положении (поз. А
на рис. 1) микрокапилляр 1 полностью находится внутри подсоединенной
к насосу отрицательного давления микропипетки 2, поэтому весь
выходящий из него раствор сразу же удаляется через боковой канал
тройника 4, не попадая в экстраклеточную среду. Через 0,2 мс
после подачи на обмотки сельсина 7 управляющих высоковольтных
сигналов возникает угловое перемещение его оси, вызывающее, в
свою очередь, поступательное движение катетера 9 вместе с микрокапилляром
1, который, выдвигаясь вперед по отношению к переднему краю
микропипетки 2 во время последующих 0,1 мс образует здесь
замкнутую зону выхода вещества (поз. Б на рис. 1).
После прохождения электрического сигнала микрокапилляр 1 в течение
1 мс втягивается внутрь микропипетки 2. При этом имеет место
интенсивное удаление из области локализации исследуемой клетки
остатков подведенного вещества. Оптимальная амплитуда управляющего
сигнала равняется 100 В, длительность - не более 10 мс.
При таких параметрах интервал времени от момента начала подачи
управляющего импульса до контакта раствора с поверхностью нейрона
составляет около 0,3 мс.
Каждый опыт включал в себя следующую последовательность
экспериментальных процедур. Полуинтактный препарат моллюска помещали
в обычную ванночку для электрофизиологического тестирования. К
области локализации исследуемой клетки сверху подводили инъекционную
иглу, из которой со скоростью 0,25 мл/мин. подавался профильтрованный
раствор Рингера для холоднокровных. Такая реализация схемы общего
протока, как выяснилось, резко снижает вероятность блокирования
входного канала насоса отрицательного давления в результате
случайного попадания в него каких-либо микрочастиц из гемолимфы
животного.
Затем к исследуемому нейрону с помощью позиционера
подводили микроаппликатор (рис. 1). По отношению к препарату
его ориентировали таким образом, чтобы в момент максимального
выхода из микропипетки последний оказывался бы на расстоянии около
30 мкм от поверхности нервной клетки. При помощи другого позиционера
к нейрону подводили регистрирующий микроэлектрод, сигнал с которого
подавался на вход усилителя биопотенциалов. Далее электрические
импульсы преобразовывались триггерным устройством и подавались
на вход генератора, формирующего сигнал запуска сельсина, а также
на вход фотостимулятора (длительность световой вспышки 0,2 мс,
время срабатывания - 0,1 мс). Последний использовали в контрольных
определениях, связанных с установлением параметров микровременной
динамики подведения вещества. С этой целью до начала эксперимента
и после его окончания микропипетку 2 (рис. 1) работающего
в обычном режиме микроаппликатора погружали в раствор этилового
спирта (96%) и освещали короткими вспышками света, синхронизованными
с сигналом запуска устройства. При частоте запускающих импульсов
порядка 2 имп/с возникает визуальный эффект неподвижного
стробоскопического изображения, соответствующего заданной (режимом
LDelay¦ фотостимулятора) микровременной стадии работы
устройства. Зона выхода вещества выглядит при этом как характерная
анизотропность (рис. 1 поз. Б), появляющаяся в растворе
спирта в определенном интервале LDelay¦.
В первой серии экспериментов проводился анализ вызванной
нейронной активности в ряду последовательных импульсных подведений
раствора Рингера для холоднокровных (рН = 7,4), содержащего
АЦХ (5 мМ). Период исследования нервной клетки включал в
себя 5 этапов, на каждом из которых осуществлялось по 20 аппликаций.
На первом из них частота ритмической хемостимуляции равнялась
1/мин. Затем продолжительность межстимульного интервала градуально
уменьшали и она составляла соответственно 30 с, 15 с,
10 с и 5 с. Период времени между моментом завершения
каждого предыдущего этапа опыта и началом следующего равнялся
15 мин.
У каждой из 18-ти зарегистрированных в этой серии
экспериментов нервных клеток отмечалась сходная динамика вызванной
разрядной активности. На первых этапах, пока интервал между хемовоздействиями
составлял более 30 с, наблюдались стабильные реакции активационного
типа, параметры которых статистически достоверно не менялись
в ряду последовательных аппликаций АЦХ (рис. 2 А,Б).
Вместе с тем дальнейшее снижение продолжительности межстимульного
интервала, как выяснилось, приводит к развитию процесса габитуации.
Начиная с Т = 15 с повторные подведения
АЦХ уже с 5-7 раза перестают вызывать появление ответных реакций
в форме спайковой разрядной активности. И, наконец, еще большее
увеличение частоты подведений АЦХ приводит к возникновению выраженных
гиперполяризационных ответов, которые, к тому же, сопровождаются
полным подавлением фоновой разрядной деятельности нейрона и резким
снижением уровня его возбудимости.
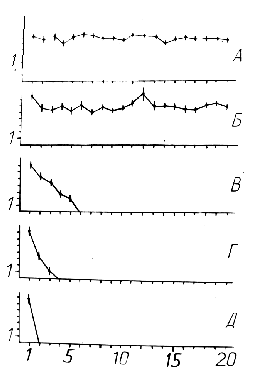
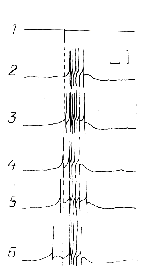
Ряд конкретных количественных характеристик, отражающих указанные изменения, был уточнен во второй серии проведенных на 24-х нейронах ППа4 экспериментов, в рамках которых основной акцент был сделан на анализе возбудимости нервных клеток при разных режимах нейромедиаторной хемостимуляции. Полученные здесь результаты, прежде всего показали, что особенностью построения вызванной нейронной активности является независимость ее параметров от конкретного момента начала первого подведения вещества (имеются в виду разные стадии процесса генерации потенциала действия). И по продолжительности латентного периода, и по степени своей выраженности соответствующие нейронные активации статистически достоверно (р > 0,05) не различались (рис. 3). Установлено, что феномен подавления возбудимости на соматическом уровне нервной клетки возникает не на заключительном этапе генерации потенциала действия, а только после завершения активационного процесса, вызванного локальным кратковременным подведением нейромедиатора. При этом, как показывают полученные результаты, возникает особая форма химической чувствительности нейрона, проявляющаяся в виде возникновения воспроизводимых гиперполяризационных (тормозных) ответов на подведение АЦХ.
Обращает на себя внимание и другой момент, а именно значительное влияние подпороговых (0,07 мМ) импульсных (Т = 10 мс) апликаций АЦХ на продолжительность периода снижения клеточной возбудимости. Установлено, что такого рода воздействие, наносимое в постактивационные интервалы времени в течение 5-10 с, вызывает значительное увеличение периода рефрактерности.
В третьей, заключительной серии опытов анализировалась динамика вызванной нейронной активности, возникающей в ответ на кратковременное (Т = 10 мс) ритмическое подведение АЦХ (5 мМ) на фоне непрерывных импульсных (Т = 10 мс) аппликаций подпороговых доз этого же вещества. Использовались два независимо работающих микроаппликатора. Период исследования каждой из 10-ти зарегистрированных здесь клеток включал в себя 5 этапов, в рамках которых при неизменной периодичности нанесения тестирующих стимулов (АЦХ, 5 мМ) - 1 раз в минуту - производилось градуальное снижение продолжительности интервала времени между подпороговыми хемовоздействиями (АЦХ, 0,07 мМ), а именно 5 с, 3 с, 1 с, 0,5 с и 0,25 с. Так же, как и в первой серии экспериментов, период между моментом завершения каждого предыдущего этапа опыта и началом следующего равнялся 15 минут. Полученные при этом данные (рис. 4) показывают, что постепенное возрастание частоты такого рода воздействий приводит к снижению степени выраженности ответа нервной клетки на пороговые подведения АЦХ, вплоть до полного подавления нейрональных реакций.
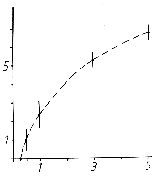
В целом полученные результаты свидетельствуют о том, что хемореактивные свойства нервной клетки определяются не только параметрами соответствующего медиаторного воздействия, но и особенностями временной организации нейромедиаторного притока, развертывавшегося на протяжении значительных интервалов времени, которые предшествовали моменту хемостимуляции. Конкретная форма проявления такого рода зависимости носит достаточно сложный характер и не сводится только лишь к развитию процесса габитуации. То, что в рамках проводимых экспериментальных исследований до сих пор основное внимание концентрировалось именно на Lгабиту-ационных¦ формах динамики вызванной нейронной активности, с нашей точки зрения, связано с некоторыми особенностями реализации метода микроионофореза, который применялся при решении этого круга задач [6-8]. В первую очередь имеется в виду значительная продолжительность каждого отдельного микроионофоретического воздействия и, как следствие, - невозможность изучения разрядной деятельности нейронов в естественной для них ситуации квантового высвобождения медиаторных молекул с последующим (также быстропротекающим [9]) их удалением из состава внеклеточной жидкости.
Немаловажную роль здесь может играть и фактор нелокальности подведения. Поскольку Lзона выхода вещества¦ при микроионофорезе составляет не менее 100 мкм [10], регистрируемый в опыте ответ, по сути дела, всегда отражает суммарную реакцию целого ансамбля синаптически связанных между собой нервных клеток. Понятно, что заявляемый анализ функциональных свойств отдельного нейрона ЦНС, не говоря уже о выяснении закономерностей хеморецепции локусов плазматической мембраны изолированной клетки [11], в рамках применяемых до сих пор методологических подходов на самом деле оказывается невозможным.
Как показывают полученные в настоящей работе результаты, преодоление отмеченных выше методических недостатков, действительно, приводит к существенному расширению круга наблюдаемых в опыте нейрофизиологических явлений. Помимо феномена габитуации здесь уже приходится сталкиваться и со строго воспроизводимыми нейрональными реакциями активационного типа, и с выраженными тормозными влияниями Lвозбуждающего¦ нейромедиатора. Такое разнообразие качественно различных форм построения вызванной нейронной активности явно не вписывается в рамки классической схемы процесса генерации потенциалов действия как простой мембранно-ионной реакции, возникающей в ответ на пороговые изменения уровня нейромедиаторного притока. Да и само понятие Lпорогового¦ воздействия (строго определенного по своим физико-химическим параметрам раздражителя, обладающего способностью возбуждать соответствующие клеточные единицы) в значительной мере теряет свой смысл.
Особенно отчетливо этот вывод выглядит в свете результатов второй и третьей серий проведенных нами экспериментов. Как показывают полученные здесь данные, необходимым условием формирования воспроизводимых ответов нейрона на аппликацию нейромедиатора является не только определенная временная структура импульсных подведений АЦХ в предстимульный интервал времени, но и стабильный паттерн Lфоновых¦ нейромедиаторных влияний. Последнее же совершенно не характерно для реального процесса межклеточного взаимодействия из-за наличия спонтанной квантовой Lутечки¦ нейромедиатора, частота которой меняется в широких пределах в зависимости от многих факторов [3-5].
Таким образом, если основной акцент исследования делать именно на способности нервной клетки возбуждаться под влиянием определенных изменений поступающего к ней нейромедиаторного притока, приходится признать, что указанную способность в принципе нельзя рассматривать в качестве некоего константного свойства, которое избирательно формируется на ранних стадиях постнатального онтогенеза [12] или при обучении [13]. Возникновение феномена Lэффективной¦ синаптической передачи на уровне любого конкретного синапса может происходить только Lex tempo¦ по мере динамического развертывания всего комплекса процессов, связанных с построением определенной нейрофизиологической интеграции.
С этих позиций совершенно очевидной является бессмысленность
все еще настойчиво предпринимаемых некоторыми авторами [14] попыток
анализировать закономерности организации элементарных нейрофизиологических
функций живого организма путем Lпрозванивания¦ на препаратах ЦНС
цепочек Lэффективно¦ взаимосвязанных между собой нервных клеток.
Сегодня уже имеются прямые экспериментальные данные, доказывающие,
что объективизируемые таким путем совокупности клеточных единиц
имеют мало общего с реальными интеграциями центрально-периферических
элементов организма, согласованная активность которых обеспечивает
достижение соответствующих результатов на организменном уровне
[15, 16].
1. Реализация механизмов интегративной деятельности нервной клетки определяется широким спектром качественно различных нейромедиаторных влияний, связанных не только с разрядной активностью пресинаптических нейронов, но и с процессами спонтанного квантового высвобождения молекул нейромедиатора.
2. В рамках процесса формирования вызванной нейронной активности решающая роль принадлежит фактору временной организации нейромедиаторного притока, развертываюшегося на протяжении значительных предстимульных интервалов времени. В результате одно и то же (потенциально Lпороговое¦) изменение уровня синаптического притока в зависимости от частотно-временных параметров последовательности предыдущих нейромедиаторных воздействий может оказывать на постсинаптическую клетку либо активирующее, либо тормозное влияние или же вообще не вызывать каких-либо изменений ее фоновой разрядной деятельности.
3. Сложная схема детерминации вызванной нейронной
активности проявляется не только на уровне фазных перестроек,
но и в характере общей динамики формирования ответов нервной клетки
в ряду последовательых хемовоздействий. В условиях квантового
высвобождения Lвозбуждающего¦ нейромедиатора с последующим (также
быстропротекающим) его удалением из состава внеклеточной жидкости
помимо явления габитуации могут иметь место и совершенно иные
нейрофизиологические феномены, а именно стабильные по своим параметрам
реакции активационного типа, а также строго воспроизводимые гиперполяризационные
сдвиги уровня трансмембранного потенциала.
1. Анохин П.К. Системный анализ интегративной деятельности нейрона // Успехи физиол. наук.- 1974.- ¦2.- С.5-92.
2. Интегративная деятельность нейрона: молекулярные основы // Мат. Международного симпозиума, посвященного 90-летию со дня рождения П.К.Анохина.- М., 1988.- 130 с.
3. Birks R.I., MacIontosh F.C. Acetylcholine metabolism at nerve endings // Brit. Med. Bull.- 1957.- ¦1.- P.157-161.
4. Fatt P., Katz B. Spontaneous subthreshold activity at motor nerve endings // J.Physiol.- 1952.- ¦1.- P.109.
5. Heuser J.E. et al. Synaptic vesicle exocytosis captured by quick freezing and correlated with quantal transmitter release // J. Cell Biol.- 1979.- ¦2.- P.275-300.
6. Пивоваров А.С. Активаторы G-белков повышают пластичность холинорецепторов нейронов виноградной улитки // Журн.высш.нервн.деят.- 1994.- ¦6.- С.1070-1076.
7. Пивоваров А.С., Котляр Б.И. Регуляция кальцием кратковременной пластичности холинорецепторов нейронов ППа3 и ЛПа3 виноградной улитки // Журн.высш.нервн.деят.- 1990.- ¦1.- С.135.
8. Пивоваров А.С., Саганелидзе Г.Н. Модуляция ионами кальция кратковременной пластичности хеморецептивной мембраны нейронов моллюска // Журн.высш.нервн.деят.- 1986.- ¦5.- С.947-955.
9. Massoulie J., Bon S. The molecular forms of cholinesterase and acetylcholinesterase in vertebrates // Annu. Rev. Neurosci.- 1982.- ¦1.- P.57
10. Котляр Б.И., Овчаренко Ю.С. Пластичность реакций нейронов сенсомоторной коры на звук, сочетаемый с электрофоретической аппликацией ацетилхолина // Журн. высш. нервн. деят.- 1976.- ¦5.- С. 971.
11. Греченко Т.Н. Соматические механизмы регуляции синаптической эффективности // Системный подход к психофизиологической проблеме.- М.: Наука, 1982.- Ред.В.Б.Швырков.- С.222-227.
12. Purves D., Lichtman J.M. Elimination of synapses in the developing nervous system // Science.- 1980.-¦1.- P.153-157.
13. Tsukahara N. Synaptic plasticity in the mammalian central nervous system // Annu.Rev.Neurosci.- 1981.- ¦2.- P.351-379.
14. Балабан П.М., Максимова О.А., Браваренко Н.И. Пластические формы поведения виноградной улитки и их нейронные механизмы // Журн. высш. нервн. деят.- 1992.- ¦6.- С.1208.
15. Александров Ю.И., Гринченко Ю.В. Изменение рецептивных полей центральных нейронов в поведении: иерархический анализ // Нейроны в поведении. Ред.В.Б.Швырков.- Наука, 1986.- С.107-119.
16. Бобровников Л.В. Особенности поведенческой
специализации стабильно- и нестабильно-активных нервных клеток
// Журн. высш. нервн. деят.- 1996.- ¦4.- С.745-752.
On the basis of Anokhin's theory of functional systems
the role of the neurotransmitter underthreshold influence on the
action potential generation was study.
Бобровников Леонид Вячеславович,
1952 года рождения. В 1975 году окончил Московский институт радиотехники,
электроники и автоматики. Кандидат биологических наук (1984 г.).
Работает в должности старшего научного сотрудника лаборатории
общей физиологии функциональных систем НИИ нормальной физиологии
им.П.К.Анохина РАМН. Начиная с 1978 года, им был выполнен ряд
оригинальных экспериментальных работ, связанных с изучением центральных
механизмов сложных форм целенаправленного поведения, исследованием
функциональных свойств нейронов в условиях микроионофоретического
самоподведения биологически активных веществ, анализом метаболического
обеспечения потенциала действия нервной клетки, с рассмотрением
особенностей формирования внутренней операциональной архитектоники
функциональной системы на последовательных стадиях системогенеза
поведенческого акта.