РОЛЬ СИНТОКСИЧЕСКИХ И КАТАТОКСИЧЕСКИХ
ПРОГРАММ АДАПТАЦИИ В ПАТОГЕНЕЗЕ МЕСТНОЙ ХОЛОДОВОЙ ТРАВМЫ (ОТМОРОЖЕНИИ).
В. Н. МОРОЗОВ*,
А. А. ХАДАРЦЕВ*, А. В. ХАПКИНА*
1.
Введение
Длительность действия и увеличение
числа факторов внешней и внутренней среды организма человека, определяющее их
взаимодействие, обуславливают повышенные требования к адаптационным механизмам
[1-3]. К таким внешним факторам, в частности, относится низкотемпературное
воздействие на ткани и организм в целом. Поэтому изучение адаптивных механизмов на примере криотравмы, как модели общего и местного поражения
функциональных систем физическими агентами, является актуальной проблемой
физиологии и медицины, имеющей научное и практическое значение.
Несмотря на определенные
успехи, достигнутые в лечении отморожений, окончательно не разрешенными
остаются вопросы патогенеза, регулирования адаптивных реакций и лечения больных с криотравмой, что
представляется особо важным для медицины мирного и военного времени.
Бытующее мнение многих
исследователей о том, что основной причиной некроза при криотравме
является непосредственное действие холода [4-6] без вторичных изменений,
связанных с перестройкой адаптивных программ при быстром согревании тканей,
находится в противоречии с имеющимся фактическим материалом [7-9].
В развитии криотравмы плодотворным является анализ гомеостатических и энантиостатических механизмов с точки зрения теории
автоматического регулирования [10]. Одним из основных свойств гомеостаза
является устойчивость биологических систем [11-12], где под устойчивостью к криотравме понимается комплекс физиологических,
биохимических и физиологических процессов, лежащих в основе адаптивных реакций,
направленных на сохранение гомеостаза или
на поддержание энантиостаза. Потому устойчивость
характеризует способность какой-либо системы организма к саморегуляции
и является одним из свойств, присущих стационарному состоянию. Отсюда понятие
стационарного состояния со всеми показателями может использоваться для оценки
механизмов гомеостаза или энантиостаза. Каждому
стационарному состоянию соответствует определенная программа, запускающая то или иное функциональное состояние в
зависимости от силы раздражителя или реактивности ЦНС [13-15]. Рассмотрение
проблемы отморожения является невозможным без учетов принципов системности.
Выяснение механизмов отморожения связано не только с местными процессами,
протекающими в зоне криотравмы, но и с
соответствующими сдвигами в адренореактивных и холинореактивных структурах мозга.
Цель настоящего
исследования - изучение основных системных механизмов адаптивной реакции на криораздражитель и определение их роли в патогенезе криотравмы с помощью предварительного активирования кататоксических и синтоксических
программ адаптации.
2.
Материал и методики исследования
Для изучения
предварительного активирования кататоксических и синтоксических программ адаптации и их роли в патогенезе
отморожения, нами были проведены эксперименты на 240 крысах, а также клинические
наблюдения на 120 больных с отморожением II-IV
степени.
У 80 крыс повышение
активности адренореактивных структур мозга создавали
предварительным интраперитонеальным введением 50 мкг на 100 грамм массы тела адреналина
гидрохлорида по 2 раза в сутки в течение 7
дней. В другой серии у 30 крыс предварительно повышалась активность холинореактивных структур мозга интраперитонеальным
введением 50 мкг на 100 грамм массы тела ацетилхолинхлорида
также во 2 раза в день в течение 7
дней. Третья группа животных (80) была контрольной.
Криотравму у всех крыс вызывали наложением хлорэтила на
тазовую лапку. Предварительно на нижнюю треть бедра накладывали жгут для
быстрого промораживания тканей и предупреждения
гипотермии. При нанесении криотравмы температура
лапок крыс снижалась до -7,4+0,06 град. С. Температуру стоп
измеряли электротермометром с игольчатым датчиком. У всех животных в различные сроки после согревания (20 минут, 2 и
4 часа, 1, 2, 5 и 10 суток), а также
у больных с отморожением в начале реактивного периода и в процессе лечения в
крови, оттекающей из зоны криотравм, исследовали
концентрацию ацетилхолина (АХ), суммарных катехоламинов (СКА), гидроперекисей
(ГП), малонового диальдегида
(МДА), общую антиокислительную активность крови
(АОА), каталазы (КАТ) по [16-20], длительность кровотечения,
концентрацию тромбоцитов и их адгезивность,
концентрацию фибриногена, растворимого фибрина (РФ), продуктов деградации
фибрина/фибриногена (ПДФ), гепарина, антитромбина III
(АТ-III), плазмина (по [21-22]), концентрацию a2-макроглобулина (a2-МГ), a1-антитрипсина (a1-АТ), активность креатинкиназы (КК) и ее изофермента (МВКК), лактатдегидрогеназы (ЛДГ) и ее изоферментов (ЛДГ-1+ЛДГ-2), имуноглобулинов G, А
и М по методам, описанным в
методических рекомендациях к соответствующим наборам реактивов фирмы "Boehringer Mannheim"
(Германия) на анализаторе ФП-90I фирмы "Labsystems"
(Финляндия).
Полученные данные
вычислялись путем расчета t-критерия
Стьюдента на ЭВМ типа РС/ХТ с использованием
пакета прикладных программ для обработки медико-биологических исследований "Statgraphics 2,6" [21].
3.
Результаты исследований
Нанесение сильной криотравмы (охлаждение тазовых лапок распылением хлорэтила
до снижения температуры стоп -7,4+0,06 град. С в течение часа) сопровождается развитием отморожения 3,8+0,02 степени с явлениями
мутиляции на 5-б сутки наблюдения. Сильная
криотравма проявляется фазовыми изменениями
артериального давления с изменением чувствительности сосудистой стенки к прессорным и депрессорным
аминам. В начале действия раздражителя отмечается повышение кровяного
давления с последующим снижением его с 100,0+1,9 мм рт. ст. до 75,0+1,8 мм рт.ст. В момент нанесения криотравмы
(ареактивный период отморожения) отмечается полное отсутствие
систолической волны по данным реовазографии, что
указывает на резкий спазм сосудов с полым прекращением кровотока. В первые часы реактивного периода криотравмы отмечается активация адренергических структур
мозга с одновременной депрессией холинергических структур, показателем которого
является снижение концентрации норадреналина в структурах подбугорья
с 0,59+0,02
нмоль/г до 0,36+0,01 нмоль/г
и увеличением концентрации ацетилхолина с 8,6+0,16 нмоль/г
до 9,5+0,14
нмоль/г с противоположными сдвигами в циркулирующей
крови. Концентрация ацетилхолина в крови снижалась с
95,6+2,5
до 43,0+3,8 нмоль/л, а кетехоламинов -
возрастала с 25,3+1,3
мкг/л до 153,5+8,4
мкг/л. Возникающая депрессия холинореактивных и активация адренореактивных
структур подбугорья способствует включению кататоксических программ адаптации с переходом в новое
функциональное состояние, направленное на защиту от поступления в общую циркуляцию
токсических веществ. Повышение
концентрации катехоламинов в
крови сопровождается различного рода альтерационными
процессами на мембранах, особенно при активации перекисного окисления липидов,
проявляющейся увеличением концентрации ГП липидов с 1,31+0,07 ОЕ/мл до 2,3+0,09 ОЕ/мл, МДА с 0,65+0,06 мкмоль/л до 1,21+0,07 мкмоль/л
и угнетением АОА с 25,5+1,4 % до 12,8+1,04 % (табл.).
Таблица 1
Динамика
изменений показателей крови при нанесении сильной холодовой
травмы (1), сильной криотравмы на фоне
повышенной
активности адренергических механизмов мозга (2) и на фоне повышенной активности холинергических структур мозга (3)
у крыс
|
Показатели |
|
Контроль |
Через 20 мин. |
Через
2 часа |
Через 4 часа |
Через 1 сутки |
Через 2 суток |
Через 5 суток |
Через 10 суток |
|
АХ
гипоталамуса, нмоль/г |
1 |
8,6+0,16 |
7,1+0,07 |
9,1+0,09 |
9,2+0,06 |
9,5+0,14 |
8,8+0,15 |
7,5+0,10 |
7,1+0,30 |
|
2 |
9,4+0,12 |
9,5+0,21 |
9,0+0,10 |
8,8+0,22 |
8,0+0,22 |
7,4+0,09 |
7,0+0,15 |
7,3+0,09 |
|
|
3 |
6,4+0,12 |
5,2+0,09 |
4,7+0,06 |
3,1+0,05 |
3,0+0,04 |
2,5+0,08 |
4,0+0,11 |
6,2+0,02 |
|
|
НА гипоталамуса, нмоль/г |
1 |
0,59+0,02 |
0,32+0,01 |
0,44+0,01 |
0,41+0,01 |
0,36+0,01 |
0,45+0,01 |
0,49+ |
0,58+0,02 |
|
2 |
0,41+0,01 |
0,35+0,02 |
0,30+0,02 |
0,31+0,01 |
0,25+0,01 |
0,29+0,01 |
0,60+0,02 |
0,62+0,04 |
|
|
3 |
0,60+0,01 |
0,57+0,02 |
0,60+0,04 |
0,51+0,02 |
0,50+0,01 |
0,54+0,02 |
0,52+0,02 |
0,57+0,01 |
|
|
Антитромбин III,
% |
1 |
90,5+1,36 |
94,8+1,51 |
71,6+2,17 |
67,3+1,74 |
55,0+2,23 |
68,6+1,30 |
80,5+3,20 |
87,6+1,22 |
|
2 |
72,1+1,54 |
65,2+1,64 |
55,0+1,68 |
54,7+2,71 |
64,1+2,58 |
78,5+2,37 |
78,5+2,58 |
95,0+1,18 |
|
|
3 |
108,6+2,72 |
105+2,61 |
102,5+3,74 |
98,5+1,92 |
95,4+2,72 |
90,0+2,62 |
90,0+2,18 |
92,1+2,36 |
|
|
a1- АТ, мкмоль/л |
1 |
36,6+1,45 |
39,0+0,96 |
48,1+1,51 |
58,0+1,93 |
60,2+1,76 |
57,8+2,31 |
46,3+1,70 |
36,6+0,14 |
|
2 |
46,2+2,16 |
48,6+2,48 |
54,5+3,62 |
68,2+3,27 |
51,2+2,58 |
48,7+1,82 |
38,7+1,89 |
35,0+1,41 |
|
|
3 |
30,1+1,29 |
32,8+1,16 |
35,4+2,49 |
35,7+2,52 |
35,5+1,53 |
38,7+1,82 |
37,8+0,20 |
39,0+2,51 |
|
|
МДА, мкмоль/л |
1 |
0,65+0,06 |
0,63+0,03 |
0,71+0,04 |
1,10+0,05 |
1,21+0,07 |
0,99+0,05 |
0,08+0,03 |
0,58+0,03 |
|
2 |
0,89+0,08 |
0,90+0,05 |
0,99+0,06 |
1,35+0,09 |
1,54+0,10 |
1,280,06+ |
0,64+0,05 |
0,60+0,08 |
|
|
3 |
0,46+0,04 |
0,47+0,05 |
0,51+0,06 |
0,50+0,07 |
0,55+0,08 |
0,600,08+ |
0,65+0,07 |
0,70+0,05 |
|
|
АОА, % |
1 |
25,6+1,40 |
23,0+0,73 |
22,1+0,74 |
17,0+0,68 |
12,8+1,04 |
14,81,16+ |
18,5+0,76 |
24,8+0,94 |
|
2 |
20,3+1,18 |
21,2+0,62 |
20,0+1,20 |
15,2+0,72 |
10,2+0,09 |
12,5+1,02 |
24,5+1,32 |
26,0+1,12 |
|
|
3 |
31,0+2,54 |
30,0+2,86 |
29,8+0,09 |
30,0+0,99 |
28,7+0,87 |
26,6+1,58 |
26,0+1,16 |
26,5+1,15 |
|
|
АХ крови, нмоль/л |
1 |
95,6+2,51 |
117,1+5,22 |
75,3+9,71 |
56,8+2,80 |
43,0+3,80 |
66,8+4,12 |
77,0+4,32 |
95,6+2,65 |
|
2 |
61,6+6,80 |
50,7+6,22 |
34,7+5,51 |
27,4+4,82 |
48,0+6,82 |
82,2+6,21 |
95,8+6,11 |
91,7+8,93 |
|
|
3 |
164,4+9,62 |
171,2+8,25 |
137,0+7,54 |
116,4+5,51 |
82,2+1,44 |
88,5+3,32 |
98,6+6,81 |
92,2+5,46 |
|
|
КК, Е/л |
1 |
1110,0+87,6 |
1300+179,4 |
1650,0+148,1 |
1900+239,9 |
3240+305,4 |
2320+279,5 |
2110+128 |
1280+81,9 |
|
2 |
1050,0+116,8 |
1230+142,6 |
2100,0+105,7 |
2880+188,5 |
3450+275,6 |
1200+118,4 |
990+78,4 |
910,0+47,2 |
|
|
3 |
1000,0+97,6 |
990,0+76,8 |
1100,0+82,8 |
1200+102,5 |
980,0+21,6 |
970,0+42,8 |
1010+75,3 |
990,0+56,1 |
Возникающее
угнетение антиоксидантных и холинергических систем сопровождается депрессией противосвертывающих механизмов крови, перестройкой гемокоагуляционной системы на локальное тромбообразование
за счет повышения активности адренореактивных
структур мозга, сопровождаясь спазмом
сосудов в зоне криотравмы и последующим их тромбозом.
На депрессию противосвертывающих механизмов крови указывало снижение
концентрации гепарина с 0,50+0,03 Е/мл до 0,23+0,02 Е/мл, АТ-III
- с 90,5+1,36
% до 55,0+2,23
% и плазмина - с 11,0+0,65 мм2 до 2,7+0,42 мм2. При
этом такой интегративный
показатель гемокоагуляции, как время свертывания крови,
снижался с 135,5+5,41 до 58,8+3,62 с. Наряду с
потреблением факторов противосвертывающей системы
крови отмечается снижение концентрации тромбоцитов с 468,3+6,1.109/л до 380,0+5,7.109/л с резким возрастанием их адгезивности с 19,0+0,89 до
49,0+3,63
%.
На торможение фибринолиза указывало и повышение концентрации антиплазминов (a2-МГ с З,8+0,11 до 6,3+0,I9
мкмоль/л и a1-АТ с 36,6+1,46 мкмоль/л до 60,0+1,76 мкмоль/л).
Сильная криотравма
выявляла стационарное состояние энантиостатических
механизмов, которое характеризуется депрессией холинореактивных,
антиоксидантных и противосвертывающих
механизмов, приводящих к нарушению кровообращения в зоне криотравмы
с последующим удалением криоповрежденных тканей. На
возникающие некротические процессы в
зоне криовоздействия указывает и повышенная
активность сывороточных ферментов. Активность ЛДГ возрастала с 560,0+20,5 до 1060,0+66,9 Е/л, КК - с 1110,0+87,б Е/л до 3240,0+305,4 Е/л и МВКК - с
28,0+7,1
до 650,0+155,9 Е/л.
Включающиеся кататоксические программы адаптации направлены
прежде всего на удаление тканей, подвергшихся криовоздействию.
Доминирование адренореактивных структур мозга
сопровождается и соответствующим вегетативным паттерном или уменьшением
активности холинергических, антиоксидантных и противосвертывающих механизмов крови с явлениями активации иммуногенеза, направленных на
поддержание устойчивости всего организма за счет удаления криоповрежденных
тканей. Кататоксические программы адаптации приводят
к локализации патологического процесса. Включение этих программ, прежде всего,
направлено на уход от криораздражителя, а при
невозможности - на удаление криоповрежденных тканей с поддержанием энантиостаза.
В функциональной системе
криотравмы биологически целесообразным является возбуждение адренореактивных
структур мозга, которые выполняют функцию усилителя, способствуя более
адекватной приспособительной деятельности организма к окружающей среде [3, 22].
Тип вегетативного реагирования в процессе формирования отморожения начинает
складываться на этапе афферентного синтеза и программируется к моменту принятия
решения. Отсюда тип вегетативного реагирования будет указывать на форму
принятия решения и соответствующую программу действия, проявляющуюся в
соответствующем вегетативном паттерне. Поэтому вегетативные компоненты криотравмы опережают поведенческую реакцию, и при
возникновении полноценных эмоциональных поведенческих реакций, связанных с той
или иной ответной реакцией, вегетативные компоненты всегда коррелируют
с формой реакции, что важно для выживания организма и является результатом
длительного биологического отбора.
Применение фармакологических средств, различных физических воздействий,
изменяющих активность вегетативной нервной системы
(повышение активности адренореактивных или холинореактивных механизмов мозга), для изучения
центральных механизмов регуляции криотравмы, с одной
стороны, открывает возможность анализа нейрохимической организации структур
мозга, участвующих в этом патологическом процессе, а с другой стороны -
представляет собой один из рациональных путей разработки методов фармакологического
воздействия на течение криотравмы.
В другой серии
исследований изучалось течение сильной холодовой
травмы на фоне повышенной активности адренореактивных
структур мозга. Повышение активности адренореактивных
структур мозга осуществлялось предварительным введением адреналина внутрибрюшинно крысам в течение недели. Тестами,
указывающими на повышение активности адренореактивных
структур мозга, являлись снижение концентрации норадреналина в структурах подбугорья с 0,59+0,02 нмоль/г
до 0,41+0,01
нмоль/г и увеличение концентрации катехоламинов в
периферической крови с 25,3+1,3 до144,0+11,9 мкг/л.
В последующем этим
крысам наносили сильную криотравму до снижения
температуры стоп -7,3+0,2 град. С с
последующим развитием отморожения 3,9+0,02 степени и мутиляцией конечности на I-2 сутки наблюдения. Подобная криотравма сопровождалась
включением кататоксических программ адаптации с
активацией адренореактивных структур мозга, процессов
ПОЛ, свертывающей системы крови и иммуногенеза. У животных
отмечалось развитие депрессии холинореактивных
структур мозга, проявляющееся снижением концентрации ацетилхолина в крови с
95,6+2,5
нмоль/л до 27,4+4,8 нмоль/л
с одновременным увеличением его концентрации в структурах подбугорья
с 8,6+0,16
до 9,5+0,14 нмоль/г. Активация кататоксических
программ адаптации с депрессией синтоксических
программ адаптации приводит к быстрому удаление криоповрежденных
тканей и восстановлению физиологических функций. Активация
адренореактивных структур мозга отражается и на
активности антиоксидантных механизмов, проявляющееся
увеличением ГП липидов с 1,31+0,07 ОЕ/мл до 2,82+0,12 ОЕ/мл, МДА - с 0,65+0,06
до 1,54+0,1
мкмоль/л и снижением АОА плазмы с 25,5+1,4 %
до 10,2+0,09
% и каталазы - с 12,0+0,57 мкат/ л до 5,4+0,45 мкат/л. Изменения в антиоксидантной системе отражаются и на противосвертывающем потенциале крови, медиаторы которой резко
потреблялись в процессе коагуляции. Так, концентрация гепарина снижалась с 0,50+0,03 Е/мл до 0,15+0,01 Е/мл, АТ-III
- с 90,5+1,36 % до 50,2+1,69 % и плазмина - с
11,0+0,6З
мм2 до 2,0+0,28 мм2. При
этом время свертывания крови ускорялось с 135,6+5,41 с
до 50,0+2,94
с, снижалась концентрация фибриногена с 10,5+0,12 до 4,8+0,09 мкмоль/л.
Бурные вегетативные изменения приводили к развитию вторичных альтерационных процессов, что отражалось и на активности
ферментов, индикаторов криотравмы. Концентрация ЛДГ
повышалась с 560,0+20,5 Е/л до 1570,0+156,9 Е/л и КК - с
1110,0+87,6
Е/л до 3450,0+275,6 Е/л.
Предварительное
активация адренореактивных структур мозга изменяет
нейрогуморальный ответ на криотравму, проявляющийся
соответствующим вегетативным паттерном или депрессией холинореактивных,
антиоксидантных и противосвертывающих
механизмов крови, что способствует более быстрому отторжению тканей. При этом
мобилизуются кататоксические программы адаптации, что
способствует быстроте перестройки программы в условиях экстремального
воздействия холода. И, чем активнее возбуждаются адренореактивные
структуры мозга, тем быстрее
включаются кататоксические программы адаптации. Возникающая сверхмобилизация
переводит организм в состояние энантиостаза с
надежным поддержанием функциональных систем и быстрейшим удалением погибших
тканей. Организм, освободившийся от криоповрежденных
тканей, быстрее становится готовым к дальнейшему росту и развитию.
В третьей серии
исследований изучалось течение сильной холодовой
травмы на фоне повышенной активности холинореактивных
структур мозга. Повышение активности холинореактивных
структур мозга осуществлялось предварительным введением ацетилхолина в брюшную
полость крысам в течение недели. Тестами, указывающими на повышение активности холинореактивных структур мозга, были снижение
концентрации ацетилхолина в структурах подбугорья с
8,6+0,16
до 6,4 +0,02
нмоль/г и увеличение
концентрации ацетилхолина в циркулирующей крови с 95,б+2,5 нмоль/л до 1б7,0+9,6 нмоль/л.
В дальнейшем этим животным наносили сильную криотравму
со снижением температуры стоп до -7,5+0,01 град. С с развитием отморожения 1,8+0,11 степени. Нанесение
сильной холодовой травмы крысам, предварительно
получившим ацетилхолинхлорид, сопровождается
активацией холинореактивных структур мозга с
включением синтоксических программ адаптации,
проявляющихся активацией антиоксидантных и противосвертывающих систем крови. Концентрация
ГП липидов снижалась с 1,31+0,07 до 1,19+0,07 ОЕ/мл, МДА - с 0,65+0,06 до 0,50+0,07 мкмоль/л, одновременно возрастала активность АОА плазмы с
25,5+1,4%
до 30,0+0,99%
и каталазы - с 12,0+0,57
до 14,8+0,64
мкат/л. Снижение активности ПОЛ тормозит развитие альтерационных процессов при криотравме,
что отражается и на антикоагуляционном потенциале.
Концентрация гепарина в процессе криотравмы не
снижалась, а оставалась в пределах контрольных величин. Активность АТ-III также слегка возрастала
с повышением активности плазмина с 11,0+0,63 мм до 20,9+2,67 мм за счет снижения
концентрации антиплазминов. Если у животных с
сильной криотравмой отмечалось резкое
ускорение времени свертывания крови, то при включении синтоксических
программ адаптации с помощью предварительного введения ацетилхолинхлорида,
наблюдалось, наоборот, замедление времени свертывания крови с 135,5+5,41 с
до 157,2+6,82
с. Сосудисто-тромбоцитарный
компонент гемостаза также не изменялся. Концентрация тромбоцитов незначительно
снижалась, что влияло на адгезивность, которая
несущественно изменялась.
Сильная криотравма у животных на фоне предварительного введения ацетилхолинхлорида выявляла стационарное состояние
гомеостатических механизмов, характеризующихся активацией холинореактивных,
антиоксидантных и противосвертывающих
механизмов крови, то есть включением синтоксических
программ адаптации.
В качестве примера
приводим данные агрегатного состояния крови по показателю КДПС [23] при
нанесении сильной криотравмы животным с нормальной
реактивностью ЦНС, на фоне повышенной активности адренореактивных
и холинореактивных механизмов мозга (рис.).
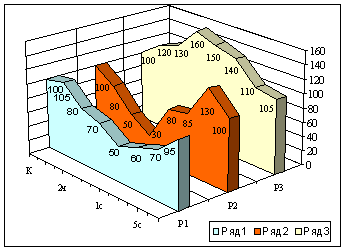
Рис. Показатель КДПС крови при нанесении криотравмы
сильной интенсивности на фоне измененной реактивности ЦНС: ряд 1 - контроль,
ряд 2 - на фоне повышения адренореактивных структур
гипоталамуса, 3 - на фоне повышения холинореактивных
структур гипоталамуса.
Как видно из рис., компенсация возмущения на
фоне измененной реактивности организма осуществляется в разные сроки. При
нормальной реактивности ЦНС возмущение на криотравму
сильной интенсивности осуществляется в течение 3-6 дней, на фоне повышенной
активности адренореактивных механизмов мозга - в
течение I-2 суток и на фоне повышенной активности холинореактивных
структур мозга - в течение 10-14 дней. Криотравма на
фоне различной реактивности ЦНС сопровождается и различными вегетативными
паттернами. При нанесении сильной криотравмы на фоне
повышенной активности адренореактивных структур
мозга, вызванной предварительным введением адреналина гидрохлорида,
вегетативный паттерн проявляется депрессией холинореактивных,
антиокислительных и противосвертывающих
механизмов крови, направленной на локализацию патологического процесса за счет криоспазма с последующим тромбообразованием,
приводящим к мутиляции
тканей. При нанесении сильной криотравмы на фоне
повышенной активности холинореактивных структур
мозга, вызванной предварительным введением ацетилхолинхлорида,
вегетативный паттерн проявляется активацией холинореактивных,
антиоксидантных и противосвертывающих
механизмов крови, направленной на сопереживание с криораздражителем
за счет улучшения агрегатного состояния крови и соответственно улучшении микроциркуляции.
У больных с отморожением II-IV
степени также наблюдается доминирование адренергических структур мозга с
депрессией холинореактивных, антиокислительных
и противосвертывающих механизмов крови. Концентрация
суммарных катехоламинов у больных с отморожением в реактивный период составляла
в среднем 135,6+5,56 мкг/л, в контрольной группе - З2,2+2,35 мкг/л. Концентрация же
ацетилхолина в реактивный период снижалась со 106,2+4,41 нмоль/л
до 59,0+2,91
нмоль/л. Отмечалось и увеличение ГП липидов с 1,40+0,08 ОЕ/мл до 1,72+0,06 ОЕ/мл, МДА - с 4,50+0,16 до 5,42+0,20 мкмоль/л
со снижением антиоксидантного потенциала. АОА снижалась
с З1,4+2,71% до 24,5+1,7% и каталаза - с 9,8+0,52 мкат/л
до 7,0+0,67
мкат/л. Депрессия антиоксидантных
механизмов сказывается и на активности противосвертывающего
потенциала крови. Концентрация гепарина
в ареактивный период отморожения снижалась с 0,47+0,01 Е/мл до 0,38+0,01 Е/мл, антитромбина III - с 95,8+4,91 до 72,4+2,48 % и плазмина - с
12,0+0,42
мм2 до 4,0+0,25 мм2 в
основном за счет активации антиплазминов.
Концентрация a2-макро-глобулина
возрастала с 3,8+0,11 до
6,0+0,21 мкмоль/л и a1-антитрипсина - с 36,8+I,64 мкмоль/л
до 59,8+3,I6
мкмоль/л.
На
повреждение тканей указывало повышение активности сывороточных ферментов -
таких, как ЛДТ - с 410,0+20,7 Е/л до 580,0+18,8 Е/л и КК - с 130,0+14,4 Е/л до 220,0+18,6 Е/л. Одновременно
повышалась и активность МВКК с 14,0+2,3 Е/л до 45,0+2,4 Е/л, - вероятно, за
счет поражения сердечно-сосудистой системы в процессе отморожения.
Выключение кататоксических программ адаптации внутриартериальным
введением комбинированных растворов, содержащих ацетилхолин, новокаин, гепарин,
фибринолизин и рауседил, изменяло вегетативный
паттерн, проявляющийся увеличением концентрации ацетилхолина в крови до 94,0+6,01 нмоль/л,
нормализацией антиоксидантного потенциала крови (АОА составляла 29,8+2,21 % и концентрация
каталазы равнялась 9,0+0,54 мкат/л
при нормализации антисвертывающего потенциала крови).
Концентрация гепарина составляла 0,60+0,02 Е/л, антитромбина III - 87,5+2,41% и плазмина - 16,0+0,84 мм.
Следовательно,
отторжение тканей при криотравме является исторически
сложившейся программой и содержит в себе феномен кататоксической
защиты. Более же древним способом защиты от криовоздействия
является сопереживание с криофактором, то есть синтоксический тип защиты. Данный вариант возможен лишь при
блокировании поведенческой и кататоксической
программы адаптации, и может быть рекомендован для снижения тяжести
некротических расстройств при отморожении.
Литература
1. Казначеев В.П. Проблемы гомеостаза в свете теории общей патологии
адаптации человека / В кн.: Гомеостатика живых,
технических, социальных и экологических систем.- Новосибирск: Наука,1990.- С .
9-19.
2. Березин Ф.Б. Психическая и психофизиологическая адаптация.- Л:
Наука, 1988.- 270 с.
3. Судаков К.В. Кибернетические свойства функциональных систем //
ВНМТ.-1998.- Т. 5, N 1.- С. 12-19.
4. Арьев Т.Я. Холодовая травма / В кн.: Патологическая физиология экстремальных состояний.- М.: Медицина,1973.- С. 224-237.
5. Пушкарь Н.С., Белоус А.М. Введение в криобиологию.- Киев: Наукова думка, 1975.- 346 с.
6. Remy B. // J. Amer. Boart. Fam / Praety.-
1998.- Vol II, N I.- P. 34-40.
7. Котельников В.П., Морозов В.Н. Современное состояние вопроса
патогенеза отморожений // Вторая конференция по проблеме "Холодовая
травма".- Л., 1989.- С. 45-47.
8. Котельников В.П., Морозов В.Н. // Вестник АМН СССР.- 1987.- N 2.-
С. 65-71.
9. Котельников В.П., Морозов В.Н. // Вестник хирургии.- 1990.- Т.144,
N 2.- с. 68-71.
10. Морозов В.Н. // Физиологическая кибернетика.- М.,1981.- С. 98-99.
11. Анохин П.К. Биология и нейрофизиология условного рефлекса.- М.:
Медицина, 1968.- 547 с.
12. Горизонтов П.Д. Гомеостаз, его механизмы и значение / В кн.:
Гомеостаз.- М.: Медицина,1981.- С. 5-28.
13. Морозов В.Н., Хадарцев А.А. // ВНМТ.-
1998.- Т. 5, N 2.- С. 82-85.
14. Морозов В.Н., Хадарцев А.А. // ВНМТ.-
1998.- Т. 5.- N 3-4.- С. 38-41.
15. Морозов В.Н., Хадарцев А.А. // Человек и
лекарство.- М., 2000.- С. 524-525.
16. Гаврилов В.Б. Мишкорудная М.И. //
Лабораторное дело.- 1983.- N З.- С. 33-35.
17. Стальная И.Д., Гарашвили Т.Г. Метод определения малонового диальдегида с помощью тиобарбитуровой кислоты / В кн.: Современные методы в биохимии.- М.: Медицина,
1977.- С. 66-б8.
18. Спектор Е.Б. Анененко
А.А., Политова Л.Н. // Лабораторное дело.- 1984.- N I.- С. 26-28.
19. Королюк М.А., Иванова Л.Н., Майоров И.Г. и др. // Лабораторное дело.- 1988.- N 1.- С. 16-19.
20. Меньшиков В.В. Методы клинической биохимии гормонов и медиаторов.-
М.: Медицина, 1969.- 158 с.
21. Григорьев С.Г., Левандовский В.В., Перфилов А.М.
Пакет прикладных программ Статграфикс
персонального компьютера.- СПб, 1992.-
104 с.
22. Судаков К. В. //
Вестник Р
А М Н.- 1997.- N 10.
- С. 4-19.
23. Патент N 2105312. Способ
диагностики степени коагулопатии
потребления / В.Н. Морозов, Ю.К. Гусак,
В.Г. Чикин и др.- 1988.
The
Role of Syntoxis
and Catatoxic Adaptive Programs in Pathogenesis of a Local Criotrauma
(Frostbiles)
V.N.
Morozov, A.A. Khadartsev, A.V. Khapkina
Summary
In the case of criotrauma the tissue detachment is the program having
co0mposed historically and incorporating a phenomenon of a catatoxic
defense. More ancient way of the defense against crioeffect
is a co-experience with the criofactor, i.e., a syntoxic type of the defense.
This variant is
possible only when behavioural and catatoxic programs of an adaptation have been blocked. It
can be recommended for decreasing heaviness of necrotic disorders in frost
bytes.
|
|
Морозов Владимир Николаевич в 1961 г. окончил Рязанский медицинский институт им. акад. И.П. Павлова. Доктор
медицинских наук. В настоящее время - профессор
кафедры медико-биологических дисциплин медфакультета
ТулГУ. Научные интересы: изучение экстремальных
воздействий на организм человека в эксперименте и акушерской и гинекологической
практике.
|
|
Хадарцев Александр Агубечирович - см. 2 стр. обложки
|
|
Хапкина Анна Владиславовна - ассистент кафедры медико-биологических дисциплин,
секретарь Совета медицинского факультета Тульского государственного
университета (ТулГУ), является соискателем при аспирантуре ТулГУ.
Автор 6 публикаций.