Динамика морфологических изменений стенок тонкой кишки после
устранения острой тонкокишечной непроходимости в эксперименте
В. Е. милюков*
В настоящее время
накоплено значительное количество данных, свидетельствующих о наличии
определенных структурных изменений в оставшейся части тонкой кишки после резекции ее участка. Однако остается не полностью изученным
вопрос, какие именно изменения являются ведущими и определяют как исход самой
операции, так и ее отдаленные результаты. Малая эффективность лечебных мероприятий
при острой тонкокишечной непроходимости во многом зависит от отсутствия решения ряда вопросов патогенеза заболевания. Вследствие
этого проводимая терапия нередко направляется только на следственный механизм
патофизиологических нарушений.
Для выявления
основных патогенетических механизмов после устранения острой тонкокишечной
непроходимости нами в эксперименте на 110 взрослых беспородных собаках обоего
пола весом 7-20 кг выполнено исследование морфо-функциональных изменений в
стенках тонкой кишки. Для всех видов исследования тонкая кишка забрана у
голодных животных, выведенных из эксперимента с соблюдением приказа МЗ СССР N
755.
После резекции некротически измененного участка тонкой кишки и
формирования энтеро-энтероанастомоза исследованы репаративные процессы в стенках тонкой кишки, проведен анализ
характера и масштаба морфо-функциональных изменений гемомикроциркуляторного
русла (ГМЦР) в стенках приводящей и отводящей петли (ПП и ОП), выявлена
корреляция изменений ГМЦР в стенках тонкой кишки и некоторых гистохимических
показателей ее тканей.
В течение 3 суток
после устранения как странгуляционной, так и обтурационной тонкокишечной непроходимости в стенке,
оставшейся после резекции некротически измененного
участка, отмечаются сдвиги, соответствующие по характеру реакции органа на
операционную травму. В сосудах подслизистой основы
отмечается спазм артериального звена ГМЦР. При этом наиболее выраженное
уменьшение диаметра просветов артериального звена ГМЦР отмечается на протяжении
первых 15 см от зоны сформированного энтеро-энтероанастомоза.
Просвет артериол, прекапилляров
и капилляров сужен (рис. 1-3, 6-8.), а посткапилляров
и венул - расширен (рис. 4, 5, 9, 10.). Капиллярная
сеть подслизистой основы становится редкой, емкость
ее резко уменьшена.
В ворсинках
слизистой оболочки в течение первых 3-7 суток после резекции некротически измененного участка тонкой кишки и
формирования энтеро-энтероанастомоза после устранения
острой тонкокишечной непроходимости, в ПП отмечаются воспалительные явления:
набухание каемчатых эпителиоцитов, помутнение их
цитоплазмы. Уменьшается активность ферментов. Количество бокаловидных клеток
увеличивается. Эпителиоциты ворсинок набухшие, высота их неодинакова. Строма ворсинок
отечная, инфильтрирована полиморфно-клеточными элементами.
В области
наложения энтеро-энтероанастомоза отмечается
зональность изменений ГМЦР. Выявлены четыре области микроциркуляторных
расстройств: зона некроза микрососудов и окружающих
их тканей; зона диапедезных кровоизлияний; зона стаза
сосудов венулярного отдела ГМЦР; зона реактивных изменений.
Выявлено, что
границы между зонами микроциркуляторных расстройств лабильны и с течением репаративного процесса изменяются. Протяженность этих зон
непосредственно влияет на динамику гистотопографических изменений при формировании
грануляционной ткани, новообразовании капилляров и реконструкции
микроциркуляторного русла. Росту новых сосудов предшествуют изменения в
прилежащих капиллярах. Эндотелии у них превращается в
первичные ангиобласты. Причем регенерация капилляров
вначале происходит в группе недифференцированных клеток. Именно из них
образуются стенки капилляров. Эти клетки группируются в виде тяжей,
расположенных в подслизистой основе тонкой кишки и
хаотично ориентированных, которые затем частично канализируются. Однако концы
вновь образованных сосудов остаются еще закрытыми. Направляясь навстречу друг
другу, они соединяются и формируют недифференцированную сосудистую трубку
капиллярного типа. Некоторое время эти трубки оставались закрытыми, не
действующими. Типичной эндотелиальной выстилки у них еще нет. В дальнейшем
стенки капилляров дифференцируются. От их боковых поверхностей вырастают новые
эндотелиальные почки. Последние также проходят фазы канализации и соединения со
стенкой рядом расположенного сосуда. На препаратах видно, что новообразование
капилляров может идти и путем формирования выростов эндотелиальных клеток из
уже действующего капилляра.
При сроке
наблюдения 7 суток после резекции петли тонкой кишки и формирования энтеро-энтероанастомоза бок-в-бок,
в сосудах подслизистой основы отмечается более
выраженный при сравнении с предыдущим сроком эксперимента спазм артериального
звена ГМЦР. Просвет артериол, прекапилляров и капилляров резко сужен (рис.1-3,6-8.}, а посткапилляров и венул - расширен
(рис. 4, 5, 9, 10.).
![]()
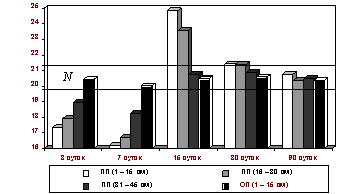
Рис. 1. Изменения диаметра артериол
подслизистой основы тонкой кишки после устранения странгуляционной 24-часовой кишечной непроходимости. Здесь
и далее: ПП - приводящая петля, ОП - отводящая петля
![]()
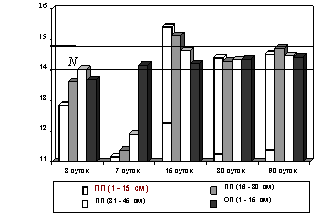
Рис. 2. Изменения диаметра прекапилляров
подслизистой основы тонкой кишки после устранения странгуляционной 24-часовой кишечной непроходимости
![]()
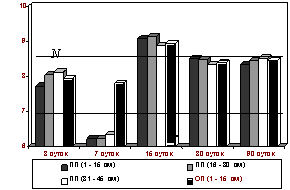
Рис. 3. Изменения диаметра капилляров подслизистой основы тонкой кишки после устранения странгуляционной
24-часовой кишечной непроходимости
![]()
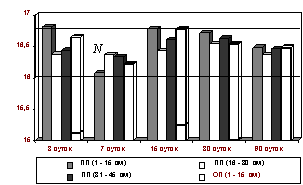
Рис. 4. Изменения диаметра посткапилляров
подслизистой
основы тонкой кишки после устранения странгуляционной
24-часовой кишечной непроходимости
![]()
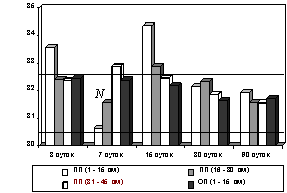
Рис. 5. Изменения диаметра венул
подслизистой основы тонкой кишки после устранения странгуляционной
24-часовой кишечной непроходимости
![]()
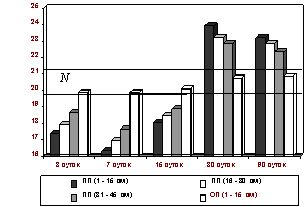
Рис. 6. Изменения диаметра артериол подслизистой основы тонкой кишки после устранения низкой обтурационной
6-суточной кишечной непроходимости
![]()
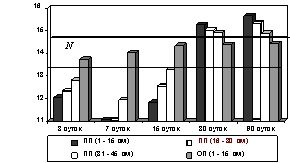
Рис. 7. Изменения диаметра прекапилляров подслизистой основы тонкой кишки после устранения низкой обтурационной
6-суточной
кишечной непроходимости
Емкость
капиллярной сети подслизистой основы ПП тонкой кишки
резко уменьшена. Спазм артериального звена ГМЦР, включая капилляры, и
расширение венозного звена ГМЦР более выражены в стенках приводящей петли,
статистически более значимы после устранения обтурационной
кишечной непроходимости, нарастают с увеличением срока, прошедшего от момента
возникновения до устранения кишечной непроходимости. У
основания ворсинок и в области крипт сосуды ГМЦР полнокровны, имеют
прямолинейный ход, в средней же и апикальной частях - резко извиты.
Между криптами сосуды ГМЦР также полнокровны, в них отмечается стаз крови с
появлением подобия гиалиновых тромбов. Отмечается снижение активности ферментов
и уровня рибонуклеопротеидного обмена в эндотелиоцитах
капилляров слизистой оболочки и подслизистой основы
тонкой кишки.
![]()
![]()
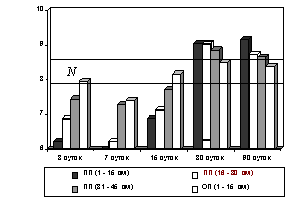
Рис. 8. Изменения диаметра
капилляров подслизистой основы тонкой кишки после
устранения низкой обтурационной
6-суточной
кишечной непроходимости
![]()

Рис. 9. Изменения диаметра посткапилляров
подслизистой
основы
тонкой кишки после устранения низкой обтурационной 6-суточной кишечной непроходимости
![]()
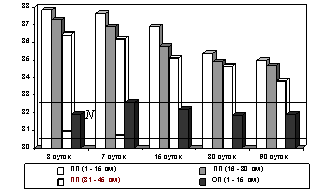
Рис. 10. Изменения диаметра венул подслизистой основы тонкой кишки после устранения низкой обтурационной
6-суточной кишечной непроходимости
Нарастающие
микроциркуляторные расстройства вызывают качественно новые нарушения на уровне микрососудов с частичным или полным нарушением кровотока в
более крупных интраорганных и внеорганных
сосудах, обеспечивающих транспорт крови к тканям, что и является причиной
наиболее частой несостоятельности энтеро-энтероанастомозов
именно в этот период.
Послеоперационные
изменения в стенках приводящей и отводящей петель в срок наблюдения от 7 до 30
суток опыта после резекции ущемленной петли тонкой кишки принимают восстановительный
характер. Эпителиальные клетки слизистой оболочки находятся в состоянии
функционального напряжения. Среди клеток эпителия появляются незрелые, молодые эпителиоциты со светлой цитоплазмой и значительно
повышенным содержанием рибонуклеопротеидов. Число интраэпителиальных
лимфоцитов увеличивается, они располагаются в межклеточных пространствах,
находятся в тесном контакте с каемчатыми эпителиоцитами. Интраэпителиальные
лимфоциты имеют достаточно большой объем цитоплазмы с хорошо развитыми
органеллами. В строме кишечных ворсинок усиливаются явления лимфоплазмоцитарной
инфильтрации. Количество кишечных ворсинок в ГМЦР уменьшается. Эндотелиальные
клетки многих капилляров кишечных ворсинок имеют признаки атрофического
повреждения - истончение эндотелия, гомогенизацию цитоплазмы, ее локальные
просветления, уплотнение базального слоя. Капиллярная сеть подслизистой
основы уплотняется за счет раскрытия нефункционирующих капилляров и расширения
просвета всех звеньев ГМЦР. Артериальные сосуды несколько суживаются, но остаются
при этом расширенными по сравнению с нормой. Венулы
увеличивают свой диаметр до статистически достоверных величин. Уменьшение
просвета микрогемососудов артериального звена
приводит к снижению емкости ГМЦР, приходящейся на ~1 мм ткани стенок кишки.
К 30 суткам
эксперимента после устранения странгуляционной
кишечной непроходимости эпителиоциты кишечных
ворсинок уплощаются, активность ферментов в них снижается, приближаясь к
исходным величинам.
Происходит
нормализация морфо-функциональных показателей сосудов диаметра просвета и
вместимости ГМЦР (рис. 1-5.). После устранения обтурационной
кишечной непроходимости даже к 90 суткам эксперимента нормализация
морфометрических показателей сосудов ГМЦР как артериального, так и венозного
его звена в приводящей петле не наблюдается (рис.6-10.). Сохраняется реактивная
дилатация сосудов артериального звена и сосудов венулярного
отдела ГМЦР. Уровень рибонуклеопротеидного обмена снижен в эпителиоцитах
кишечных ворсинок, эндотелиоцитах капилляров кишечных
ворсинок и эндотелиоцитах капилляров подслизистой основы тонкой кишки, а в
ОП - увеличен. Все это свидетельствует о сохраняющихся циркуляторных
нарушениях и о незавершенности процессов репарации слизистой оболочки и подслизистой основы кишечной стенки.
Результаты этой
серии экспериментов также показали, что после резекции некротически
измененного участка тонкой кишки с формированием энтеро-энтероанастомоза
развертывание компенсаторно-приспособительных процессов соответствует 4 стадиям.
Первая стадия: в течение 3-7 суток в стенке ПП после резекции некротически измененного участка тонкой кишки отмечаются
сдвиги, соответствующие по характеру реакции органа на операционную травму. Репаративные процессы проявляются в значительной
активизации обменных процессов, т.е. в росте уровня рибонуклеопротеидов в эндотелиоцитах капилляров ворсинок и капилляров подслизистой основы. При этом отмечается значительное
уменьшение емкости ГМЦР подслизистой основы
приводящего отдела тонкой кишки.
Вторая стадия
компенсаторно-приспособительного процесса длится 7-15 суток после резекции и
формирования энтеро-энтероанастомоза. Она
характеризуется наличием репаративных
послеоперационных изменений - периодом роста сосудов, характеризующимся
увеличением количества, общих и средних величин длины, диаметра, коэффициента
деформации, углов ветвления сосудов всех порядков ветвления (слияния),
отсутствием окончательной дифференцировки всех слоев стенок сосудов,
нарастанием содержания нуклеиновых кислот.
Морфо-функциональная
перестройка с 15 до 30 суток после резекции некротически
измененного участка тонкой кишки и формирования энтеро-энтероанастомоза
может быть определена как период инволютивных
изменений кровеносного русла (третья стадия), который характеризуется
уменьшением количества сосудов ГМЦР, их длины, диаметра, коэффициента
деформации и углов ветвления (слияния). В стенках микрососудов
ослабляется реакция на нуклеиновые кислоты.
С 30 суток
эксперимента после резекции некротически измененного
участка тонкой кишки и формирования энтеро-энтероанастомоза
начинается период стабилизации (четвертая стадия) морфо-функциональных
показателей сосудов. Отмечается восстановление диаметров просветов сосудов ГМЦР
и нормализация содержания нуклеиновых кислот в эндотелиоцитах
капилляров слизистой оболочки и подслизистой основы
ПП и ОП тонкой кишки.
Эти сроки нами
определены после устранения острой странгуляционной
тонкокишечной непроходимости. После устранения острой обтурационной
тонкокишечной непроходимости период инволютивных
изменений наблюдался нами и на 90 сутки эксперимента.
Таким образом, при
всей сложности и многообразии патологических механизмов синдрома острой
кишечной непроходимости различной этиологии общим ключевым звеном, определяющим
глубину и обратимость поражения, являются микроциркуляторные изменения в
кишечной стенке. Они носят однотипный характер, зависят от вида кишечной
непроходимости и от длительности послеоперационного периода после резекции некротически измененной петли тонкой кишки.
Dynamics
of Morphological Changes in an Intestinal Wall after Eliminating of an acute Intestinal
Obstruction in an Experiment
V. E. Milyokov
Summary
Trough there are
many different and complex pathological mechanisms of an acute intestinal
obstruction syndrome due to different etiology, a common key symptom estimating
the depth and reversibility of the lesion is microcirculatory changes in the
intestinal wall. They are of the same kind and depend on a type of an
intestinal obstruction and duration of a post-operative period since resection
of necrotically-changed intestinal loop.