ДИНАМИКА
АКТИВНОСТИ ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ В
ПРОЦЕССЕ НЕОАНГИОГЕНЕЗА СТИМУЛИРОВАННОГО ВОЗДЕЙСТВИЕМ ВЫСОКОИНТЕНСИВНОГО
ЛАЗЕРНОГО ИЗЛУЧЕНИЯ НА ИШЕМИЗИРОВАННЫЕ ТКАНИ
Е.С.
ГОЛОВНЕВА*
Введение. Нарушение кровоснабжения тканей и органов
возникает при целом ряде заболеваний: при ишемической болезни сердца, облитерирующих заболеваниях артерий нижних конечностей,
системных заболеваниях, поражающих сосуды микроциркуляторного русла. Во многих
случаях медикаментозное лечение не дает желаемого эффекта либо развивается толерантность к применяемым
медикаментам, и требуется хирургическая коррекция ишемии. К сожалению, прямые
реконструктивные операции не всегда возможны у данного контингента больных
из-за тяжести общего состояния либо тотального поражения не только крупных, но
и мелких сосудов. Созданные оперативным путем сосудистые шунты часто подвергаются облитерации, тромбируются и склерозирутся [2,
3]. Отрицательные стороны традиционных способов лечения заставили
исследователей искать другие пути реваскуляризации ишемизированных органов
Новые хирургические
методики с применением лазерных технологий являются одним из способов решения
проблемы реваскуляризации ишемизированных
тканей. Прежде всего, это - операции трансмиокардиальной
реваскуляризации, коррекция ишемии мышц нижних
конечностей и портальной гипертензии при циррозах печени. Несмотря на очевидный клинический эффект этих
операций, до сих пор нет объяснения механизма положительного влияния
высокоинтенсивного лазерного (ВИЛ) воздействия на сосудистые системы органов и
тканей. В предыдущих работах мы показали, что при морфологическом исследовании
тканей миокарда, мышц и печени, подвергшихся воздействию лазера, отмечается
формирование на месте лазерных каналов соединительной ткани с многочисленными
капиллярами, часть из которых постепенно дифференцируется до артерий и вен мелкого калибра. Новая
сосудистая сеть анастомозирует с кровеносными
сосудами в прилежащих областях и тем самым компенсирует дефицит кровоснабжения
тканей [1, 3]. В этом случае идет речь об активации процесса неоангиогенеза.
Формирование новых сосудов (неоангиогенез) возможно при двух основных условиях:
во-первых, это наличие в тканях факторов роста - специфических цитокинов, усиливающих митотическую, пролиферативную и
миграционную активность эндотелиальных и гладкомышечных клеток, а во-вторых, достаточная активность
протеолитических ферментов, создающая базисные условия для миграции клеток и
образования новых сосудистых структур. Протеазы системы плазмина (плазмин,
активаторы плазминогена (ПА) тканевого и урокиназного типов) и группа коллагеназ
(матриксных металлопротеиназ - ММП) являются ведущими
модуляторами неоангиогенеза. Эти ферменты составляют
так называемый протеиназный каскад, в котором последовательно активируются
латентные формы протеиназ и тем самым расширяются
возможности лизиса внеклеточного матрикса - начиная с фибрина и заканчивая комплексным
протеолизом всех матриксных структур.
Целью нашей работы
являлся анализ динамики активности протеолитических ферментов - ММП и
активаторов плазминогена в процессе неоангиогенеза, стимулированного ВИЛ-воздействием
на ишемизированные ткани.
Материалы и
методы исследования. Эксперимент проведен
на 280 белых беспородных крысах, массой 180-200 г. Источником лазерного
излучения являлся диодный лазер "Альто 300" (Россия)
с длиной волны 805 нм, доставка энергии излучения осуществлялась через моноволоконный кварцевый световод.
В ишемизированных тканях печени и мышц формировали по
2 канала глубиной 5 мм, в миокарде - один лазерный канал, достигавший полости
левого желудочка. Животные выводились из эксперимента на сроках 1, 5,
10, 20, 30, 90 суток.
Активность ММП исследовалась методом прямой зимографии с
предварительным вертикальным
электрофорезом (напряжение - 150 В, 2 часа) гомогенизата
тканей в 10% полиакриламидном геле с додецилсульфатом
натрия и добавлением 0,1% желатина в качестве субстрата. После разделения
белков пробы, гели инкубировали в трис-Cl буфере с
добавлением хлорида Ca (рН 7,8) в течение 16 часов при 37 град. С, затем фиксировали и окрашивали 0,5% кумасси бриллиантовым синим [6]. Протеолитическая
активность ММП визуализировалась в качестве обесцвеченных полос на синем фоне,
локализация которых соответствовала молекулярной массе каждого из ферментов,
определяемой по стандартам молекулярной
массы (ICN).
Активность ПА определялась методом прямой
зимографии гомогенизата
тканей в 1% агарозном геле, содержащем в качестве
субстрата казеин-молоко (0,1%) и плазминоген
человеческой плазмы (1 Ед./ 1 мл геля (ICN)), при рН 7,4. Гель с нанесенными на поверхность пробами в
течение 16 часов инкубировали в термостате при 37 град.
С затем,
фиксировали уксусной кислотой и окрашивали 0,1% амидовым
черным. Оценку протеолитической активности ПА определяли измерением диаметра
зоны лизиса геля вокруг пробы (в мм).
Полученные результаты. Зимографическая картина активности коллагеназ в контрольных образцах ишемизированных
тканей миокарда, мышц и печени
оказалась достаточно сходной.
Констатировалась слабая активность ММП 2, латентной (72 кД)
и активной (68 кД) фракций. После ВИЛ-воздействия, с
5 суток во всех тканях начинал
повышаться уровень активной фракции ММП 2, тогда как статистически достоверное
увеличение активности латентной фракции отмечалось только в печени и мышцах. На
10 сутки во всех образцах продолжал повышаться уровень ММП 2, примерно в 2
раза, и была выявлена активность ММП 9,
представленная в основном латентной фракцией фермента (92 кД). На 20-30 сутки активность желатиназ
была максимальной. Уровень активной формы ММП 2
вырос по сравнению с контролем в 10 раз, а уровень активной фракции ММП 9 (88 кД) в 2 раза превышал уровень, зарегистрированный нами на 10-е сутки. На 90 сутки активность
ММП 9 отсутствовала, уровень ММП 2 оставался несколько выше данных контроля
(рис. 1, 2).
Определение суммарной активности
ПА в контрольных образцах показало стабильный базальный уровень этих
ферментов в тканях. Повышение активности
начинало отмечаться уже с первых суток после ВИЛ-воздействия, причем уровень ПА
в миокарде был достоверно выше, чем в печени и мышцах. Значительное увеличение активности ПА
наблюдалось с 5-х по 20-е сутки эксперимента, а
максимальные значения констатировались на 10 сутки. В этот период мы отмечали, что уровень активности ПА в ткани печени значительно превышал показатели мышц и
миокарда. После 20-х суток эксперимента уровень ПА снижался и к 90 суткам
практически возвращался к норме (рис. 3).
Наличие определенного базального уровня коллагеназы ММП 2 и ПА являлось отражением того, что в ишемизированных тканях постоянно протекают процессы ремоделирования тканевых структур и миграции клеток, причем
уровень этой активности даже несколько превышает протеолиз
в нормальных тканях. В предыдущих исследованиях нами было показано, что ВИЛ-воздействие на ткани играет триггерную
роль в активации ряда клеточных элементов (тучные клетки, тромбоциты) [1, 3]. Прежде всего, это обусловлено термическим
эффектом лазера. Реакция дегрануляции тучных клеток и
тромбоцитов приводит к выходу в окружающие ткани биологически активных веществ,
содержащихся в них, а именно: основного фактора роста фибробластов и фактора
роста сосудистого эндотелия. Известно, что эти цитокины
обладают способностью активировать синтез клетками протеолитических ферментов -
ММП и ПА.
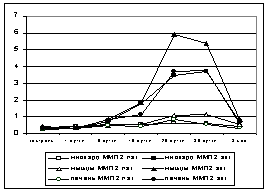
Рис. 1. Динамика активности
ММП 2 (латентной и активной формы) в
ишемизированных тканях после ВИЛ-воздействия

Рис. 2. Динамика
активности ММП 9 (латентной и активной
формы) в
ишемизированных тканях после ВИЛ-воздействия
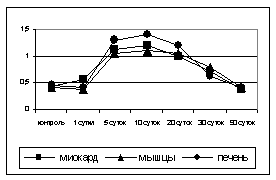
Рис. 3.
Динамика суммарной активности ПА
после ВИЛ-воздействия на ткани.
Затем, в ответ на ВИЛ-воздействие,
развивается локальный воспалительный процесс, в ходе которого последовательно активируются сателлитные клеточные популяции, такие как макрофаги,
эндотелиальные, гладкомышечные клетки сосудов,
фибробласты. Все
вышеперечисленные мигрирующие клетки
могут служить источниками
протеолитических ферментов в зоне ВИЛ-воздействия [5, 6]. Уровень
ПА максимален с 5 по 20 сут. в
период инфильтрации тканей нейтрофилами,
макрофагами, и на этапах начала пролиферации сосудистых клеток. Максимальная активность ММП, отмеченная на
20-30 сут., видимо, обусловлена концентрацией в
области лазерного повреждения тканей наибольшего количества пролиферирующих
эндотелиальных, гладкомышечных клеток и (в особенности) коллагенобластов.
Кроме того, ПА
преобразуют плазминоген в плазмин, который способен
конвертировать латентные формы коллагеназы ММП 2 в
активные [6]. Именно поэтому, с нашей точки зрения, отмечается столь выраженное возрастание уровня активной формы ММП 2 в очаге
ВИЛ-воздействия. Интересным представляется факт появления значительной
активности ММП 9 в лазерной ране. Авторы, исследовавшие уровень этого фермента
при повреждении сосудистой стенки, отмечают достаточно слабую ответную реакцию
ММП 9 [7]. Однако изучение реакций соединительной ткани и хрящевых поверхностей
показывает значительное повышение уровня ММП 9 [4]. В случае лазерного воздействия
реакция этой группы ферментов видимо отражает мощную функциональную активность
популяции фибробластов - коллагенобластов II типа, зафиксированную нами в тканях при
помощи трансмиссионной электронной
микроскопии [3].
Нельзя не упомянуть
о синергизме действия протеолитических
ферментов и факторов роста в тканях в
процессе неоангиогенеза. Протеолиз
внеклеточного матрикса приводит к активации депонированных там цитокинов, в частности - фактора роста фибробластов. В свою
очередь, выделяющиеся при повреждении
тканей (в том числе и лазерном) факторы роста являются стимуляторами синтеза
клетками протеиназ
и их рецепторов [7]. Особая роль принадлежит фактору роста сосудистого
эндотелия, который способен резко усиливать проницаемость сосудистых стенок
[6]. Это вызывает выход составляющих плазмы крови в окружающие ткани и
активацию процессов внесосудистого свертывания, а
затем и фибринолиза. Благодаря запуску протеазного каскада возрастают возможности лизиса матрикса
и миграции клеток, что является необходимым для разрушения старых сосудистых
структур и формирования новых.
Непосредственная
зависимость динамики активности протеолитических ферментов от репаративных процессов, протекающих в области лазерного
воздействия, подтверждает наши выводы о том, что неоангиогенез
является адаптивной, стереотипной реакцией ишемизированных
тканей на повреждающее ВИЛ-воздействие.
Литература
1. Головнева Е.С. // Лазерная медицина.- 2001.-
Т. 5, N 3.- С. 29-31.
2. Ишенин Ю.М. и
др. // Медицина и экол.-1997.-.N 2.- С. 57-59.
3. Козель А.И и др.
// Хирургия.- 2000.- N 11.- С. 8-10.
4. Fujisawa T. et al.
// J. Biochem.- 1999.- Vol. 245.-Р. 966-975.
5. Moscatelli D.et al.
// Ann. NY Acad. Sci.- 1998.- Vol. 650.- P. 177-181.
6. Senger D. R. // Am. J.. Path.- 1996.- Vol. 149.- P. 1-7.
7. Tyagi S. et al.
//
Dynamics
of a Proteolytic Ferment Activity in the Process of Neoangiogenesis Stimulated
with Exposing the Ischemic Tissues to a High-Intensity Laser Radiation
E. S.
Golovnyova
Summary
The levels of
activity of matrix metalloproteinases and plasminogen activators are increased after exposing the ischemic
tissues to high-intensity laser
radiation. Really a major
sources of proteases were satellite cells, such as mast cells, fibroblasts, platelets, macrophages,
endothelial and smooth muscle cell of vessels. We consider neoangiogenesis
is a stereotypical, adoptive reaction of the ischemic tissues on a laser
damage.
Key words: matrix metalloproteinases, plasminogen
activators