эрозивно-язвенные повреждения
желудочно-кишечного тракта
у обожженных
Е.н. Матчин, Т.Е. Марышева*, А.А.
Хадарцев
В последние годы возрастает интерес к острым эрозивно-язвенным
повреждениям желудочно-кишечного тракта (ЖКТ) при различных клинических состояниях
в связи с их учащением, трудностью своевременной диагностики, малой
эффективностью консервативного и оперативного лечения [2-4]. Особый интерес
представляют эрозивно-язвенные поражения (ЭЯП) у обожженных [1, 6-7]. Из всех
осложнений, развивающихся при ожогах, острые ЭЯП ЖКТ остаются самой серьезной
хирургической проблемой. Изучение литературы по этой теме показывает, что при
обширных ожогах они являются главной причиной смертельных исходов после сепсиса
и шока [5]. Наряду с вопросами
неотложной диагностики пристально изучаются аспекты развития ЭЯП, выясняется
роль портальной гипертензии в генезе изъязвлений ЖКТ, не определены взаимоотношения
портального кровотока с печеночным лимфообращением у
обожженных, хотя нарушения лимфообращения в печени
имеют определенное патогенетическое значение в портальной гипертензии. Изучение
роли иммунологических нарушений при ожоговой болезни - предмет активного
изучения в свете современных представлений о роли иммуноглобулинов и функций Т-лимфоцитов,
представляющийся существенным не только в теоретическом аспекте объяснения
механизмов возникновения острых изъязвлений ЖКТ у обожженных, но и в
практических целях усовершенствования методов диагностики, прогнозирования,
профилактики и лечения.
Тесты, позволяющие адекватно оценивать тяжесть интоксикации
у тяжелообожженных, отсутствуют, поэтому выбор точных
методов диагностического тестирования для оценки степени интоксикации у
обожженных с острыми ЭЯП ЖКТ для прогнозирования исхода заболевания и
определения показаний к дифференцированному назначению эфферентной терапии
имеет значение в совершенствовании лечения тяжелообожженных.
Цель исследования - разработка мероприятий, направленных на улучшение
диагностики, прогнозирования, профилактики и лечения острых ЭЯП ЖКТ у обожженных;
проведение анализа клинических и лабораторно-инструментальных обследований 331 больного в возрасте от 1 года до 85 лет с
обширными (на площади от 10% до 65% поверхности тела) ожогами. Мужчин было 216
(65,25%), женщин - 115 (34,75%), а также проведен ретроспективный анализ
историй болезни и протоколов вскрытий 138 умерших от термической травмы за
период 1993-1996 гг.
При обследовании больных с ЭЯП изучали анамнез, течение,
частоту их возникновения в зависимости от тяжести термического поражения,
адекватности терапии. Всем больным проводилось эндоскопическое исследование
желудка и 12-перстной кишки. Эндоскопическое обследование велось фиброгастродуоденоскопом IF-B2 и GIF-K2 фирмы
"Olympus", во время которого у отдельных
больных прицельно брали биоптаты в зоне язв и эрозий.
Комплексному исследованию подвергали кровь из портальной системы, лимфу из
грудного лимфатического протока (ГЛП). В динамике проводили порто- и лимфотонометрию в главном лимфатическом коллекторе с
определением прессорного градиента в устье ГЛП, реогепатографию, рассчитывали лейкоцитарный (ЛИИ) индекс
интоксикации (Я.Я. Кальф-Калиф, 1941),
спектрофотометрическим способом на приборе СФ-26 определяли уровень молекул
средней массы (МСМ) (Габриэлян Н.И., 1985) Для оценки
состояния детоксикационной функции печени
флуоресцентным методом на анализаторе АКЛ-01 ЗОНД определяли эффективную
концентрацию альбумина (ЭКА) и рассчитывали связывающую способность плазмы
(Миллер Ю.И., Добрецов Г.Е. 1991). Численное определение иммуноглобулинов проводили
методом простой радиальной иммунодиффузии по Manchini et al. (1965)
Процентное и абсолютное количество Т-клеток определяли методом
спонтанного розеткообразования по Jondal et al. (1972) в
модификации П.Д. Зуева с соавт. (1978). Для определения
В-лимфоцитов применяли метод Mendes et al. (1973) с
дополнениями Р.В. Петрова с соавт. (1985) Число О-лимфоцитов считали косвенным способом по методу Froland, Natvig (1973) путем
вычитания %-уровня Т- и В-лимфоцитов от 100%. Содержание циркулирующих
иммунных комплексов (ЦИК) - методом преципитации с 3,5% раствором полиэтиленгликоля.
Таблица 1
Показатели гидро- и
гемодинамики при дренировании ГЛП
|
Исследуемые величины
(мм вод. ст.)
|
Перед
дренированием
ГЛП
|
После
дренирования
|
Р
|
|
Давление в ГЛП
|
396,4+ 11,0
|
228,0+ 32,0
|
<0,01
|
|
Портальное давление
|
187,0+ 21,0
|
128,0+ 11,0
|
<0,05
|
|
Кавальное давление
|
36,0+ 6,0
|
83,0+ 11,0
|
<0,01
|
|
Портокавальный
градиент
|
141,0+ 23,0
|
48,0+ 13,0
|
<0,01
|
При эндоскопическом исследовании у больных с обширными
ожогами острые ЭЯП ЖКТ встречаются в 24,5% наблюдений. В группе больных без
профилактических мероприятий частота ЭЯП составила 38,5%. В группе, где
проводились профилактические мероприятия (эфферентные методы детоксикации, ингибиторы Н+-, К+-АТФ-азы,
блокаторы гистоминовых Н2-рецепторов),
частота их снизилась до 7,4%. Проведенное нами у 23 больных с глубокими ожогами
на площади от 20 до 60% поверхности тела бужирование
и катетеризация пупочной вены с одновременным дренированием ГЛП выявили
взаимосвязь давления в главном лимфатическом коллекторе и пупочной вене.
Показатели гидро- и гемодинамики в момент канюляции ГЛП и после наружного отведения лимфы из ГЛП
приведены в табл. 1
В ранней стадии ожоговой болезни значительно страдает
печеночный кровоток, о чем говорило повышенное портальное давление - оно колебалось
от 135 до 240 мм вод. ст. в зависимости от тяжести ожога и в среднем равнялось
187,0+ 11,0 мм вод. ст., при этом величина давления в ГЛП в среднем была
396,4+ 11,0 мм вод. ст.. Величина кавального давления
в нижней полой вене на уровне печени колебалась от 0 до 115 мм вод. ст. и в
среднем составила 36,0+ 6,0 мм вод. ст., что указывало на значительное депонирование
крови в гепатопортальной системе и нарушение
кровотока в печеночном отделе портального русла. При эндоскопическом
исследовании визуальный осмотр слизистой оболочки желудка и луковицы 12-перстной
кишки выявил значительные макроизменения,
проявляющиеся отеком, очаговой гиперемией, подслизистыми
кровоизлияниями у всех больных. Из-за
венозного застоя в портальной системе возникали функциональные и
морфологические изменения ЖКТ, приводящие к нарушению барьерной функции
кишечника и проникновению микрофлоры в кровь. Бактериологические анализы крови,
взятой из портальной системы через реканализированную
пупочную вену, показали в 21% случаев присутствие кишечной палочки
Для предупреждения или уменьшения функциональных и
структурных нарушений органов брюшной полости доказана эффективность внутрипортальных инфузий через реканализированную пупочную вену (100-150 мл 0,5% раствора
новокаина, 10 мл 2,4% раствора эуфиллина, 1-2 мл 2%
раствора папаверина, введение реополиглюкина 5,7-11,4
мл\кг с гепарином, α-токоферола
0,02-0,04 мл/кг. Особенно эффективными оказались внутрипортальные
переливания артериальной крови (взятой у родителей тонкой иглой из бедренной
артерии) и прямые гемотрансфузии. Внутрипортальный
путь явился эффективным путем регионарного подведения антибиотиков. Указанный
путь позволял действовать на микрофлору, мигрирующую из ЖКТ. Высокая
концентрация антибиотиков в гепатопортальном русле,
создаваемая за счет регионарного подведения, способствовала проникновению их в
лимфатическую систему печени, а, следовательно, и в ГЛП, поскольку 60-80%
лимфы, содержащейся в главном лимфатическом коллекторе, оттекает от печени.
Проведен анализ изотопных гепатограмм у 19 больных с
острыми изъязвлениями ЖКТ. 10 больным проводилось трансумбиликальное
подведение лекарственных средств, 9 - в подключичные и бедренные вены.
Графически период максимального накопления индикатора
в печени, начало, окончание и продолжительность плато у больных с трансумбиликальным подведением лекарственных веществ к
печени был достоверно короче, чем в группе, где инфузионно-трансфузионная
терапия проводилась в подключичные и бедренные вены. Результаты исследования
см. рис. 1, 2. Наиболее эффективным оказалось внутрипортальное
введение лекарственных средств с наружным отведением лимфы из ГЛП.

Рис. 1. Вид
изотопной гепатограммы у больного с введением
лекарственных средств в обычные вены

Рис. 2. Вид
изотопной гепатограммы у больного с регионарным
подведением лекарственных средств непосредственно к
печени через реканализированную пупочную вену.
При морфологических исследованиях прижизненных пунктатов печени выявлено, что в 1-е сутки после ожога у
всех обнаруживался отек паренхимы и субкапсулярного
слоя печени. На гистологических препаратах видны явления лимфостаза,
образования больших застойных лакун в лимфатическом коллекторе. Дольчатое
строение печени и трабекулярная структура долек
нарушались за счет дискомплексации печеночных балок
(рис. 3).
Своевременное
отведение лимфы из ГЛП устраняло застой в печени. Прижизненная пункционная
биопсия печени на 3-5 день после дренирования ГЛП с последующим гистоморфологическим
исследованием показала, что, устраняя застой лимфы в
печени, лимфатикостомия способствовала
интерстициальной дегидратации печени, "высушивала" пространства Диссе и Малла. Эндотелий
капилляров, отслоенный от поверхности печеночных балок до наружного отведения
лимфы из ГЛП, после дренирования тесно прилегал к поверхности печеночных балок.
Восстанавливалась архитектоника печеночных балок. Наружное отведение лимфы в
лечении обожженных устраняло микроциркуляторные нарушения в печени и портальной
системе (рис. 4).
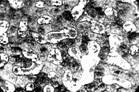
Рис. 3. Патологогистоло-гическое исследование N 4843, больного Б.
на 6 день после ожога перед дренированием ГЛП
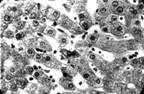
Рис. 4. Патологогистоло-гическое исследование N 4562, больного Б.
через 5 дней после дренирования ГЛП и наружного отведения лимфы
из главного лимфатического коллектора
Ожоговая травма приводит к значительному снижению общей
иммунологической реактивности у обожженных. Нами осуществлено параллельное
определение количественных параметров иммунологическеих
механизмов у больных с ЭЯП и ожоговых больных без патологических изменений в
ЖКТ, изучение динамики содержания иммуноглобулинов и Т-розеткообразующих
лимфоцитов под влиянием различных методов лечения. Уровень гуморального и
клеточного иммунитета в сравниваемых группах ожоговых больных представлено в
табл. 2
Как видно по табл. 2, в группе больных с ЭЯП имеется
статистически достоверное (Р<0,01) снижение IgG и IgA с одновременным
незначительным повышением IgM. Особенно заметно снижался IgA. По мере выздоровления происходит нормализация уровня
IgG и
IgM, тогда как уровень IgA у
больных с изъязвлениями в ЖКТ даже перед выпиской из стационара не достигает
нормальных величин. Это указывает на определенную предрасположенность людей с
дефицитом IgA к
острым ЭЯП ЖКТ.
Общее и относительное количество Т-лимфоцитов в
периферической крови ожоговых больных обеих групп было сниженным в сравнении с
контрольной группой доноров, причем у пациентов с ЭЯП снижение уровня Т-лимфоцитов
было существенным и достоверным (Р<0,01) и в сравнении с больными, не
имевшими изъязвлений в ЖКТ. Общее и относительное количество активных Т-лимфоцитов
в периферической крови было повышено в сравнении с контрольной группой доноров.
В группе больных с изъязвлениями число активных Т-лимфоцитов было
достоверно выше (Р<0,01), чем у не имеющих изъязвлений.
В результате изучения гепатопортальной
гемодинамики выявлены расстройства воротного кровообращения и кровоснабжения
печени у тяжелообожженных. При этом страдает функция
печени, как органа ретикулярно-эндотелиальной системы. Возникает депрессия
защитных механизмов организма. Поэтому целесообразно применение при
ожоговой болезни стабилизаторов, влияющих на биоактивные вещества и мембраны
клеток.
Таблица 2
Состояние гуморального и клеточного иммунитета в
сравниваемых группах ожоговых больных
|
Показатели
иммунитета
|
Контроль
|
Больные без
изъязвлений в ЖКТ
|
Больные с острыми
изъязвлениями в ЖКТ
|
|
M+ m
|
M+ m
|
P1
|
M+ m
|
P1
|
P2
|
|
IgG, мг %
|
1275+ 34,1
|
1061+ 58,2
|
<0, 001
|
1032,3+ 69
|
<0,001
|
<0,05
|
|
IgA, мг%
|
176,6+ 8,5
|
225,5+ 3,1
|
<0,001
|
123,0+ 3,4
|
<0,001
|
<0,001
|
|
IgM, мг%
|
133+ 8,8
|
118,7+ 4,3
|
<0,05
|
155,6+ 4,7
|
<0,05
|
<0,05
|
|
T-лимфоциты
Число
в 1 мкл, %
|
1560+ 24 73+ 8,3
|
1369+ 33,1
67,7+ 7,3
|
<0,01
<0,05
|
1204+ 4,1
55+ 1,8
|
<0,01
<0,01
|
<0,01
<0,05
|
|
Активные
Т-лимфоциты
Число в 1 мкл, %
|
503,1+ 12,1
23,6+ 1
|
590+ 14,3
27,9+ 4,6
|
<0,01
<0,05
|
694+ 20,1
31+ 7,8
|
<0,001
<0,05
|
<0,01
<0,05
|
Примечание: Р1 - достоверность
различия в сравнении с нормой;
Р2 - достоверность различия в
сравниваемых группах ожоговых больных
Нами проведен анализ двух групп больных, одна из которых
(18 обожженных) в процессе лечения указанные препараты не получала, вторая
группа (11 больных) получала контрикал или гордокс, а 7 человек из них получали сыворотку реконвалесцентов в дозе от 150 до 600 мл. Уровень
сывороточных иммуноглобулинов для обеих групп перед назначением антиоксидантов
составил: для Ig G 635+ 27,2 мг%, для IgA -184,6+ 5,2 мг%. На 10-14
день уровень IgG для обеих групп был 1208,6+ 58,2 мг%,
причем у больных, получавших мембраностабилизирующие
средства, содержание IgG равно 1298,7+ 49,2 мг%. Для
группы без мембраностабилизирующих средств концентрация
IgG
достоверно (Р<0,01) была ниже и равнялась 1007,8+ 42,1 мг%.
Если уровень иммуноглобулина А в первые дни
ожоговой болезни был выше, чем в контроле и равнялся 184,6+ 5,2 мг%, то на 10-14 день концентрация иммуноглобулинов для
группы больных, лечившихся мембраностабилизирующими
средствами, достоверно не изменялась и достигала 176,4+ 8,3 мг%,
тогда как в группе больных, не получавших антиоксиданты, у 10 пациентов содержание
иммуноглобулина А достигло 322,2+ 21мг%, течение ожоговой болезни у них
осложнилось пневмонией, а у оставшихся 8 уровень иммуноглобулина А
снизился до 129,5+ 32 мг%. В группе больных со
сниженным уровнем иммуноглобулина А у всех при эндоскопическом
исследовании выявлены ЭЯП.
11 пациентов со сниженной иммунологической реактивностью,
резистентных к обычной терапии, получали гипербарическую оксигенацию
(ГБО) в барокамере типа "Ока-МТ" Создаваемое давление в ней колебалось от 1,6
до 2 ата, количество сеансов на одного больного - от
4 до 16 на курс лечения.
Обследовано 27 ожоговых больных, при этом у 11 больных
со сниженной иммунологической реакцией, резистентных к обычной терапии,
своевременное включение ГБО в комплекс лечения вело к достоверному увеличению
тех классов иммуноглобулинов, исходный уровень которых был снижен: Ig G - с 1024+ 28 до 1285+ 37 мг%,
IgM -
с 98+ 13 до 129+ 12 мг% У 8 больных назначение ГБО
понизило уровень иммуноглобулинов: IgG - с 1498+ 43 до 1246+ 36 мг%,
IgA -
с 318+ 19 до 143+ 21 мг%. Под воздействием ГБО
отмечалось нарастание розеткообразующих клеток и
увеличение общего числа лимфоцитов, если исходный их уровень был снижен: Т-лимфоцитов
- с 868+ 23 до 1570+ 43 в 1 мкл крови, активных Т-лимфоцитов - с 327+ 23 до
398+ 17, лимфоцитов - с 1211+ 23 до 1898+ 58 клеток в 1 мкл.
Обладая способностью стимулировать гуморальный и клеточный
иммунитет, находящийся в состоянии гипореактивности,
снижать число Т-лимфоцитов и уровень иммуноглобулинов при повышенном их
содержании, перечисленные мероприятия оказались неэффективны только при очень
низкой иммунологической реактивности у 7 умерших в первые стадии ожоговой
болезни. Вызывая сходный иммунологический ответ, левамизол,
антиоксиданты и ГБО на фоне комплексной терапии способствуют у обожженных
восстановлению иммунологической реактивности.
Для адекватной оценки патофизиологических нарушений и степени
интоксикации при тяжелых ожогах нужны точные методы диагностического
тестирования. Практический интерес представляет способ, предложенный М.Я.
Малаховой и соавт. (1989). Он позволяет определить
уровень средне- и низкомолекулярных веществ белкового происхождения в плазме и
на эритроцитах, отражающих активность протеолитических процессов в организме
больного. С целью повышения информативности предлагаемого метода разработаны
показатели токсемии, учитывающие одновременно как уровень веществ низкой и средней
молекулярной массы (ВНСММ), так и концентрацию олигопептидов,
определяемых в плазме и на эритроцитах после осаждения высокомолекулярных
белков методом Lowry (1951). Индекс токсемии
(ИТ), отражающий степень эндогенной интоксикации, представляет собой условную
величину, рассчитываемую как произведение концентрации ВНСММ и олигопептидов в плазме (ИТп) или
эритроцитах (ИТэ). Общая оценка эндотоксемии
производится с помощью индекса интоксикации (ИИ), получаемого при суммировании
(ИТп) и (ИТэ). ЭКА - эффективнвая концентрация альбумина; ССП - связывающая
способность плазмы.
Нами обследовано 67 больных в возрасте 5-62 лет с глубокими
термическими ожогами на площади от 15 до 60% поверхности тела, причем у 18 из
них ожоговая болезнь осложнилась острыми ЭЯП ЖКТ. Контроль составили 27 здоровых
доноров. Сравнительный анализ уровня эндогенной интоксикации в 2-х группах
больных с ЭЯП в ЖКТ и без
них представлен в табл. 3.
 Таблица 3
Таблица 3
Уровень эндогенной интоксикации у больных с
эрозивными изменениями в ЖКТ и без них
|
Показатели
интоксикации
|
Без
эрозивно-язвенных
изменений
|
С
эрозивно-язвенными
изменениями
|
Р
|
|
ВНСММ
|
в плазме
|
13,6+ 0,5
|
30,3+ 0,2
|
<0,01
|
|
на эритр.
|
35,28+ 0,13
|
33,16+ 3,0
|
>0,5
|
|
Олигопептиды
|
в плазме
|
0,92+ 0,12
|
1,87+ 0,4
|
<0,01
|
|
на эритр.
|
0,97+ 0,07
|
1,87+ 0,1
|
>0,5
|
|
ИТ
|
в плазме
|
16,3+ 0,89
|
57,5+ 0,4
|
<0,01
|
|
на эритр.
|
33,08+ 0,30
|
35,07+ 0,6
|
>0,5
|
|
Суммарный ИИ
|
49,39+ 1,24
|
93,6+ 0,8
|
<0,01
|
|
ЭКА
|
19,5+ 0,40
|
18,7+ 0,5
|
>0,5
|
|
ССП
|
29,5+ 0,08
|
28,7+ 0,3
|
>0,5
|
Примечание: ВСНММ, олигопептиды,
индекс токсемии и суммарный индекс интоксикации даны в условных единицах;
Р -
достоверность разницы между двумя группами; ЭКА - эффективная концентрация
альбумина
Как представлено в
табл. 3, у больных с ЭЯП в ЖКТ в сравнении с контролем в 2 раза (с 13,6+ 0,5 до
30,3+ 0,2 у.е.) повысился в плазме крови уровень
ВНСММ; более чем в 2 раза ( с 0,92+ 0,1 до 1,87+ 0,4 у.е.)
повысился уровень олигопептидов, более чем в 3 раза
(с16,3+ 0,89 до 57,5+ 0,4 у.е.) индекс токсемии в
плазме крови. В 2 раза (с 49,39+ 1,24 до 93,6+ 0,8 у.е.
) повысился в плазме суммарный ИИ. В то же время уровень ВСНММ, олигопептидов и индекс токсемии на эритроцитах оставался на
уровне контроля и достоверно не повышался.
Не достоверны были
изменения эффективной концентрации альбумина и связывающей способности плазмы.
Результаты говорят о том, что ЭЯП ЖКТ возникают у обожженных на фоне выраженной
эндогенной интоксикации в фазе полного насыщения сорбционной емкости
эритроцитов токсическими продуктами нарушенного метаболизма при дальнейшем
росте уровня токсических веществ в плазме.
Лишь с восстановлением кожного покрова существенно
снижался уровень эндогенной интоксикации.
Пластика ожоговых ран с использованием культуры фибробластов
приводила к достоверному снижению уровня ВСНММ в плазме с 13,6+ 0,5 до
10,17+ 0,22 у.е. на эритроцитах - с 35,28+ 0,13 до
31,71+ 0,17 у.е. в сравнении с дооперационным
периодом, к снижению суммарного индекса интоксикации с 49,39+ 1,24 у.е., к повышению эффективной концентрации альбумина с
19,5+ 0,4 до 23,5+ 0,61 г/л и связывающей способности плазмы с 29,5+ 0,08 до
36,0+ 0,8%.
Выводы:
1. Острые ЭЯП ЖКТ у обожженных являются тяжелым осложнением
ожоговой болезни. При эндоскопическом исследовании при обширных ожогах они
встречаются в 24,5% случаев. В группе, где не проводились профилактические
мероприятия (эфферентные методы детоксикации, ингибиторы
Н+-, К+-АТФ-азы , блокаторы гистаминовых Н2-рецепторов
) частота ЭЯП составила 38,5%, в группе больных с использованием профилактических
мероприятий частота их снизилась до 7,4%.
2. У тяжелообожженных под
действием регионарного подведения лекарственных средств к печени быстрее
восстанавливается функциональная активность полигональных клеток. Наружное
отведение лимфы из ГЛП приводит к нормализации гидро-
и гемодинамики в портальной системе, улучшает спланхническое
лимфо- и кровообращение. При нормальном
функционировании дренажа эндоскопически определялось
уменьшение отека, гиперемии, кровоточивости слизистой оболочки, исчезновение петехиальных кровоизлияний.
3. Острые ЭЯП ЖКТ у обожженных сопровождаются достоверным
снижением уровня IgG и IgA, уменьшением общего и относительного количества Т-лимфоцитов
с одновременным повышением IgM и активных Т-лимфоцитов.
Высокая степень корреляции уровня IgA и количества Т-лимфоцитов
с изменениями в ЖКТ у обожженных позволяют предполагать участие иммунологических
механизмов в генезе острого язвообразования. Вызывая
сходный иммунологический ответ, левамизол,
антиоксиданты, ГБО способствуют восстановлению иммунологической реактивности у
обожженных, являются профилактической мерой развития острых ЭЯП и лечебным
средством при их развитии.
4. Степень эндогенной интоксикации отражает ИТ - величина,
рассчитываемая, как произведение уровня концентрации ВНСММ и олигопептидов в плазме и на эритроцитах. Общая оценка эндотоксемии проводилась с помощью индекса интоксикации,
получаемого при суммировании ИТп и ИТэ.
Эндогенная интоксикация у ожоговых больных с ЭЯП значительно
и достовернее выше в сравнении с ожоговыми больными, не имеющими таких
осложнений. Высокая степень корреляции уровня эндогенной интоксикации с морфологическими
изменениями в верхних отделах ЖКТ подтверждают роль эндогенной интоксикации в
генезе острых изъязвлений.
Литература
1. Вихриев Б.С. Острые
хирургические заболевания органов пищеварения у обожженнных.-
Л.: Медицина, 1985.- 162 с.
2. Курыгин А.А. и
др. // Вестн. хир.- 1989.- N 1.- С. 11-13.
3. Cioffi W.G. et.al. // J. Trauma.- 1994.- Vol. 36.- P. 544-546.
3. Hall K.V. et.al. // Surg..- 1984.- Vol.
18, N 1.- Р. 157-162.
5. Kolar I. et.al // Хирургия.- 1972.- N 10, С. 25-28.
6. Pruitt B.A. et.al // Bull. Clin. Rev.
Burn Injuries.- 1984..- N 1.- Р. 43-44.
7. Zhou Y.P. et.al // Burs.- 1993.- Vol. 19.- Р. 150-152.
Erosive-Ulcerative
Injuries of the Gastroenteric Tract in the Case of Extensive Burns
E. N.
Matchin, T.E. Marysheva, A.A. Hadartsev
Summary
Endoscopic examination of 331
patients having extensive burns (10-65%of the body surface) revealed acute
erosive-ulcerative injuries of the upper sectors of the digestive tract in
24.5% of observations. the authors noted a connection between acute ulceration
development and disorders of hepatoportal blood- and lymphocirculation,
changes in an immunologic status, a degree of endogenic
intoxication.
Key words: erosive-ulcerative
injuries, digestive tract




