Озонотерапия в многофакторной
профилактике факторов риска ишемической болезни сердца
Е. И. Сычева*
По словам академика Е. Чазова, вторая половина ХХ века
ознаменовалась своеобразной революцией в возможностях лечения больных с
ишемической болезнью сердца (ИБС). Достижения в борьбе с болезнями системы
кровообращения изменили не только средства и методы лечения, но и представления
об этих нозологических формах, продемонстрировав возможность их эффективной
профилактики, в том числе первичной и на популяционном уровне. В 1998г.
исполнилось 50 лет Фремингемскому исследованию (Framingham Heart Study), изменившему подходы к пониманию заболеваний
сердечно-сосудистой системы и определившему необходимость участия врача в
профилактических программах. Результаты Фремингемского
исследования позволили убедительно доказать роль гиперхолестеринемии
(1957), артериальной гипертонии (1957, 1970), сахарного диабета (1974),
менопаузы (1976), ожирения (1967) как факторов риска ИБС и инсульта. Среди
факторов риска этой группы, ставших хрестоматийными и сделавших невозможным
лечение ИБС без контроля липидного спектра крови, следует особо отметить
факторы, относящиеся к образу жизни (курение, малоподвижный образ жизни) и
корректируемые немедикаментозными воздействиями. По
мере продолжения Фремингемского исследования
расширяются представления о других факторах риска: в их число вошли, в
частности гиперфибриногенемия (1987), липопротеиды (1994) и увеличение размеров левого
желудочка (1994), гипергомоцистеинемия (1996). Полученные
данные исследований обогатили медицинскую практику представлением о независимых
факторах риска - тех, воздействие которых само по себе способно ухудшить
прогноз существующего заболевания или привести к его возникновению. Помимо
лекарственного воздействия непосредственно на симптомы сердечно-сосудистых
заболеваний, врач должен уметь эффективно бороться с факторами риска.
"Если ожидать проявления симптомов ишемической болезни сердца у всех
пациентов, подверженных действию факторов риска, прежде чем начинать лечение,
то первым симптомом нередко может стать внезапная смерть" (M.Brown, J.Goldstein).
Одним из основных факторов риска
является гиперхолестеринемия [14]. В основе дислипопротеидемий лежит мутация структурного гена,
кодирующего синтез рецепторов. Этот дефект уменьшает плотность рецепторов,
связывающих атерогенные фракции липопротеидов. Низкая
плотность этих рецепторов уменьшает их связывание и ведет к избыточному
накоплению в свободно циркулирующей крови липопротеидов низкой плотности (ЛПНП)
и нарушению их метаболизма. По характеристике липидного спектра было предложено
деление на 5 типов [18], из которых типы IIА и III являются наиболее атерогенными, когда имеется четкий дефицит рецепторов к
ЛПНП, значительное содержание холестерина, липопротеидов и соотношение апоВ/апоА>1. В последние годы
выявлена важная роль в развитии атеросклероза коронарных артерий иммунных
механизмов, в частности, образование аутоиммунных
комплексов "липопротеид - антитело". В состав таких комплексов в
качестве антигена входят наиболее атерогенные классы
липопротеидов - низкой и очень низкой плотности (ЛПОНП). Появление у
липопротеидов аутоантигенных свойств является итогом
их модификации в результате перекисного окисления липидов (ПОЛ), гликозилирования и т.д. [6]. Гладкомышечные клетки и
макрофаги под влиянием повреждения эндотелия и избытка ЛПНП начинают
пролиферировать. В процессе пролиферации в их цитоплазму проникает большое
количество липидов. Происходит трансформация макрофагов в пенистые клетки,
которые и составляют атерому [15]. Прочность атеросклеротической бляшки
определяется состоянием ее фиброзной капсулы, покрышки, отделяющей богатое
липидами тромбогенное ядро от крови. Бляшки,
предрасположенные к разрывам, называются "ранимыми". Их характеризует
большое ядро и тонкая покрышка, содержащая малое число гладкомышечных клеток.
Капсулу ослабляет воспаление внутри бляшки, сопровождающееся инфильтрацией Т-лимфоцитов
и макрофагов. Воспалительная реакция рассматривается как один из основных
механизмов ослабления покрышки, т.к. макрофаги являются источником ферментов,
разрушающих коллаген и другие элементы капсулы. Стимуляторами макрофагов и Т-лимфоцитов
являются перекисноокисленные ЛПНП.
В ряде эпидемиологических
исследований доказано, что ряд факторов, участвующих в процессе свертывания
крови, увеличивают риск развития ИБС. Это - повышенный уровень в плазме
фибриногена, VII фактора свертывания крови,
фактора Виллебранда; повышенная агрегация
тромбоцитов, сниженная фибринолитическая активность.
Наиболее детально изучена роль фибриногена как самостоятельного фактора,
увеличивающего риск развития сердечно-сосудистых заболеваний в 2-3 раза. При
ИБС отмечается рост агрегации тромбоцитов и появление микроагрегатов в
разветвлениях коронарных артерий, которое обусловлено увеличением продукции
тромбоцитами тромбоксана и гиперпродукцией
прокоагулянтных факторов, что ведет к нарушению микроциркуляции и прогрессированию ишемии миокарда.
Динамическое равновесие между тромбоксаном и простациклином при ИБС нарушается в сторону увеличения
первого. Это также является одним из важнейших звеньев патогенеза ИБС [1].
Доказана роль процессов
перекисного окисления липидов в патогенезе ишемических повреждений миокарда [5,
8]. Усиление свободно-радикального ПОЛ при
атеросклерозе развивается вследствие увеличения содержания холестерина в биомембранах ткани сосудов при гиперхолестеринемии
и расценивается как нормальная физиологическая реакция, направленная на
выравнивание стабильности физико-химических характеристик липидного бислоя. Обратной стороной процесса является образование при
этом в токе крови перекисноокисленных, т.е.
модифицированных атерогенных липопротеидов [3-4,
11-12]. Их патологическую суть определяет то, что модифицированные липопротеиды
в силу своей токсичности повреждают эндотелиальный покров артерий, являясь
первопричиной атеросклеротического процесса, кроме того,идет интенсивное накопление их с помощью макрофагов
в эндотелиальных клетках сосудов, в местах повреждения, происходит их
трансформация в пенистые клетки, составляющие основу атеросклеротической
бляшки. Активация ПОЛ связана с накоплением липидных гидроперекисей,
образующихся за счет свободно-радикального окисления,
а также возрастания уровня активаторов оксидантной
системы и накопления в кардиомиоцитах жирных кислот.
Чрезмерная активация ПОЛ усугубляет тяжесть энергетического дефицита,
расстройство электромеханического сопряжения и угнетение функции кардиомиоцитов. Активация ПОЛ способствует усилению
агрегации тромбоцитов [17]. Накопление катехоламинов в сердце стимулирует ПОЛ,
дестабилизирует мембраны лизосом, ведет к выходу протеолитических ферментов и аутолизу субклеточных структур и клеток миокарда. Имеется
взаимосвязь степени интенсификации свободно-радикальных
процессов с тяжестью ИБС и состоянием системы антиоксидантной
защиты [16].
ИБС - одно из самых
тяжелых по течению и последствиям заболеваний и, несмотря на колоссальные
инвестиции в ее профилактику и лечение, сохраняет 1-е место среди причин
смертности. С теоретической и практической точек зрения
важным для оценки риска развития сердечно-сосудистых заболеваний явилось
введение понятия о суммарном (глобальном) риске (учитывается взаимодействие
между собой ряда факторов с более значительным ростом риска, чем при их простом
суммировании у конкретного лица).
Успешно развиваются новые технологии, направленные на
улучшение качества диагностики, лечения и профилактики. Озонотерапия
является одним из перспективных направлений для лечения и профилактики
сердечно-сосудистых заболеваний и ИБС. Действие озона на организм человека
многообразно. Накоплен большой фактический материал, который
позволяет считать, что действие озона при введении в организм проявляется на
субклеточном, клеточном, тканевом, органном, системном и организменном уровнях
[9]. Одна из точек приложения озона - ПОЛ. Большое число патологических
процессов сопровождается нарушением ПОЛ полполиненасыщенных
жирных кислот (ПНЖК), как входящих в состав различных мембранных структур
клеток, так и используемых в качестве энергетического субстрата. Введение озона
усиливает ПОЛ, но и стимулирует внутриклеточный синтез антиоксидантов. Это дает
возможность клетке осуществлять для энергетических целей не только внутри-, но и внемитохондриальное
окисление жирных кислот в процессе w-окисления глиоксилатного цикла. При различных патологических
состояниях, сопровождающихся гипоксией, происходит внутриклеточная
трансформация жирных кислот в углеводы и связанное с этим усиление гликолиза.
ПНЖК являются своего рода внутриклеточными "гормонами", регулирующими
синтез и активность основных ферментов катаболизма жирных кислот, а также их пероксисомальное окисление. При озонотерапии
в гепатоцитах возрастает содержание пероксисом и мембран гладкого эндоплазматического ретикулума, т.е. ультраструктур, с которыми связаны
процессы синтеза каталазы, цитохрома Р450
глиоксилатного цикла и w-окисления ПНЖК. Озон активно взаимодействует с ненасыщенными жирными кислотами, разрывая длинные цепи на
более короткие фрагменты, которые проникают в митохондрии и включаются в b-окисление с
образованием ацетил-КоА и последующей активацией
цикла лимонной кислоты.
Несмотря на ряд теоретических публикаций о
разнообразных биологических свойствах озона, применение озонотерапии
в комплексе санаторного лечения пациентов с ИБС и стенокардией напряжения не
описано.
Цель работы - оценка влияния озонотерапии на динамику
биохимических показателей крови, отражающих ее реологические свойства и
состояние прооксидантной и антиокислительной
систем у больных стенокардией на санаторном этапе лечения; разработка
адекватной методики применения озонотерапии в
комплексе санаторно-курортного лечения (СКЛ) у больных ИБС и стенокардией I-III ФК в условиях влажного субтропического климата
Сочи.
Материал и
методы. Обследовано 313 пациентов со
стенокардией напряжения I-II-III ФК. В основной группе пациентов, получавших
комплексное санаторно-курортное лечение и озонотерапию,
было обследовано до и после лечения 217 человек, из
них: мужчин - 143 чел. (65,9%), женщин - 74 чел. (34,1%).В
контрольной группе с традиционным санаторно-курортным лечением обследовано 96
человек, из них мужчин - 58 (60,4%) чел., женщин - 38 (39,6%) чел.. Под
наблюдением находились преимущественно больные с ИБС: стенокардией напряжения II ФК (218 чел), с
длительностью заболевания до 5 лет - 151 чел. (48,2%), с наиболее частыми
факторами риска: артериальной гипертензией - 206 чел (65,8%), гиперхолестеринемией - 225 чел. (71,9%); нарушениями
в системе гемостаза - 147 чел. (46,9%). Из сопутствующих заболеваний отмечены: мочекаменная болезнь - у 68 чел., сахарный диабет
- у 52 человек. В 34 случаях у больных в анамнезе был перенесенный инфаркт
миокарда.
Курс озонотерапии состоял из внутривенного капельного введения
озонированного физиологического раствора (ОФР) - 200,0 мл с концентрацией озона
1,0-1,5 мг/л 2-3 раза в неделю в количестве от 5 до 9 процедур в комплексе
санаторно-курортного лечения с учетом показанных режимов двигательной
активности, на фоне талассотерапии, аэротерапии, гелиотерапии,
"щадящей" бальнеотерапии, гидропатических процедур, диетотерапии. Применялся тот диапазон
концентраций озона, при использовании которого не происходило активации ПОЛ в
экспериментах in vitro. Для контроля и подбора схемы лечения
использовался метод определения ПОЛ и активности антиокислительной
системы организма методом индуцированной биохемилюминесценции
Комплексно
обследовали всех больных до и после лечения.
Показатели коагулограммы определяли на 2-канальном
оптическом коагулометре Cormay
KG-1. Кинетику агрегации тромбоцитов оценивали с помощью 2-канального
лазерного анализатора ("Biola LTD -
230", Россия). В качестве индуктора агрегации использовали аденозиндифосфат (АДФ) в концентрации 0,5 мкМ. Получали липидограмму,
при этом содержание общего
холестерина (ХС), триглицеридов (ТГ) определяли
ферментативным методом, холестерин липопротеидов высокой плотности (ХС ЛПВП) -
флотационным методом на аппарате Cormay Plus. Уровень холестерина липопротеидов очень низкой
плотности (ХС ЛПОНП) определяли как ТГ/2,2. Уровень холестерина липопротеидов
низкой плотности ХС ЛПНП рассчитывали по формуле Фридвальда:
ХС ЛПНП = общий ХС - (ХС ЛПВП + ТГ/2,2). Определение ПОЛ и активности антиокислительной
системы организма вели методом индуцированной биохемилюминесценции
(ИБХЛ), при которой происходило
каталитическое разложение перекиси водорода ионами металла с переменной
валентностью - двухвалентным железом [01][10]. Измерение
ИБХЛ велось на БХЛ-06, сопряженном с IBM PC/AT в
диалоговом режиме (разработка Нижегородского НИЦ
"Биофармавтоматика"). Статистическая обработка материала проводилась на основе
статистического пакета "Stastistika
5.0". Статистически значимыми считали различия при р<0,05.
Результаты. По данным литературы, эффект торможения атерогенеза при применении озонотерапии
обеспечивается за счет уменьшения количества атерогенных
фракций липопротеидов и непосредственно зависит от нормализующего влияния озона
на восстановление динамического равновесия между ПОЛ и антиоксидантной
системой защиты организма [9, 13]. Данные анализа динамики липидного обмена и
ПОЛ у больных стенокардией основной группы служат доказательством приводимых
выше эффектов озонотерапии. Под влиянием озона
достоверно снижался средний уровень общего холестерина на 18,4%, атерогенных фракций липопротеидов: ЛПНП и ЛПОНП на 28,7%,
ТГ на 17,2%, индекса атерогенности на 24,1%. В
основной группе в ходе лечения выявлена тенденция к повышению ЛПВП на 3,7%. В
контрольной группе достоверных результатов не получено.
В последние годы
большое внимание в профилактической медицине уделяется выявлению групп риска на
основе уровней риска развития ИБС по содержанию ХС ЛПВП в крови при дислипорпротеидемиях [7]. Для проведения такой оценки
пациенты, получавшие озонотерапию, были разделены по
полу и уровням риска ИБС: высокий и умеренный (у мужчин при ХС ЛПВП<1,45, у
женщин <1,68); нулевой (у мужчин при ХС ЛПВП>1,45, у женщин>1,68). При
оценке параметров липидограммы в основной группе с
высоким и умеренным риском у мужчин выявлено достоверный рост ЛПвП с 1,17+0,02 до 1,30+0,03
ммоль/л, достоверное снижение индекса атерогенности с 4,64+0,11 до 3,28+0,09 у.е., общего холестерина - с 6,61+0,22
до 5,57+0,13 ммоль/л, ТГ - с 1,64+0,09
до 1,42+0,07 ммоль/л, ЛПНП - с 4,77+0,01
до 3,57+0,03 ммоль/л, ЛПОНП - с 0,75+0,07
ммоль/л до 0,66+0,08 ммоль/л;
в группе мужчин с нулевым риском отмечался достоверный спад общего холестерина
с 6,83+0,16 до 5,64+0,18 ммоль/л, ЛПНП
- с 4,34+0,09 до 3,41+0,07 ммоль/л и
выявлена тенденция к снижению индекса атерогенности и
ТГ, что указывало на улучшение липидного обмена. В основной группе женщин с
высоким и умеренным риском выявлен достоверный рост ЛПВП с 1,22+0,03 до
1,35+0,04 ммоль/л и достоверное снижение
индекса атерогенности с 4,28+0,04 до 3,09+0,06
у.е., общего холестерина - с
6,38+0,14 ммоль/л до 5,46+0,25 ммоль/л, ТГ - с 1,75+0,14 до 1,49+0,08 ммоль/л, ЛПНП - с 4,25+0,08 до 3,25+0,13 ммоль/л, и ЛПОНП - с 0,84+0,08 до 0,68+0,04 ммоль/л; в группе с нулевым риском - достоверное снижение
индекса атерогенности с 2,23+0,09 до 2,02+0,11
у.е. и снижение объема ЛПНП.
Под влиянием озонотерапии нормализовался обмен липидов
и липопротеидов.
О компенсации реакций свободно-радикального
окисления свидетельствуют результаты ИБХЛ плазмы пациентов, изучение которой
является наиболее адекватным методом оценки свободно-радикальных процессов в биосубстратах. По результатам хемилюминесцентного анализа
плазмы выявлено, что в процессе лечения озоном происходило достоверное
увеличение отношения Imax/S на 13,1%, отражающего общую антиоксидантную
активность (АОА) плазмы, и снижение максимальной интенсивности свечения (I max) на 8,7%. Достоверных
изменений показателей светосуммы (S) не наблюдалось. В контроле после обычного санаторно-курортного лечения
отмечено лишь появление тенденции к увеличению Imax/S с 0,106+0,004 до 0,111+0,005
(z=1,58). Результаты свидетельствовали о торможении
процесса ПОЛ и активации АОА крови после озонотерапии,
и о том, что применяемые концентрации озона в процессе лечения были
эффективными и безопасными.
Процессы активации ПОЛ и антиоксидантной
системы в организме больных основной и контрольной групп шли неодинаково
(рис.). В основной группе у больных стенокардией при применении озонотерапии уже в середине курса лечения отмечалось
снижение активности ПОЛ с возрастанием АОА системы. В
контроле наблюдалась иная картина: к середине лечения имела место некоторая активация
процессов ПОЛ, что объясняется перестроечными процессами в организме прибывших
на курорт людей, связанными с реакциями адаптации к новым климатогеографическим
условиям, к воздействию лечебно-оздоровительных мероприятий традиционного СКЛ.
В конце пребывания на курорте в контроле шел спад интенсивности ПОЛ и рост АОА,
но менее выраженное, чем в группе больных
стенокардией, получавших озонотерапию. Результаты
подтверждают позитивное влияние озона на активизацию процессов антиокислительной защиты организма, что согласуется с
данными [2, 9, 19]
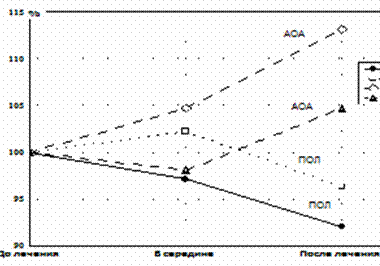
Рис. Динамика показателей ПОЛ и АОА плазмы крови; обозначения:
![]()
![]() - показатели основной группы;
- показатели основной группы; ![]()
![]() - контроля
- контроля
Патогенез ИБС и
стенокардии обусловлен ростом агрегации тромбоцитов с появлением микроагрегатов
в разветвлениях коронарных артерий и нарушением динамического равновесия в
системе свертывания крови и фибринолиза с тенденцией
к гиперкоагуляции крови. Оценка изменений параметров коагулограммы больных основной группы подтверждает гипокоагуляционный эффект низких концентраций озона. При
применении озона было достоверное снижение количества фибриногена с 3,65+0,11
до 3,31+0,09 г/л, тромбинового времени - с
46,04+1,08 до 43,08+1,14 с; рост активированного частичного тромбинового времени с 36,81+1,28 до 41,36+1,11
с, времени рекальцификации с
каолином - с 71,96+1,58 до 75,47+1,37 с, что отражало оптимизацию
в пределах нормы показателей плазменно-коагуляционного
звена гемостаза. После лечения озоном наметилась тенденция к снижению протромбинового индекса. Одновременно шло достоверное
снижение показателей спонтанной с 5,21+0,08 до 4,73+0,06 % и
индуцированной агрегации тромбоцитов - с 64,15+2,31 до 57,01+2,03%,
что говорило о положительном влиянии озонотерапии на сосудисто-тромбоцитарное звено гемостаза. Статистически
достоверное повышение фибринолитической активности
плазмы с 12,66+0,08 до 15,05+0,07 подтверждало благотворное
влияние озонотерапии на фибринолитическое
звено гемостаза. В контроле достоверной динамики этих показателей не было. Это
говорит о позитивном влиянии озонотерапии на гемостаз
с гипокоагуляционным эффектом, что улучшает
реологические свойства крови.
Практические рекомендации. Для больных стенокардией
в условиях влажных субтропиков рекомендован курс парентерального метода озонотерапии в комплексе с традиционным СКЛ, состоящий из
5-6 процедур в/в капельных инфузий озонированного
физиологического раствора в объеме 200 мл, проводимых не чаще 2-3 раз в неделю. Эффективными и
безопасными для внутривенной озонотерапии у больных
ИБС: стенокардией I-III ФК являются концентрации озона в изотоническом
растворе хлористого натрия от 1,0 до 1,5 мг/л.
Для контроля
безопасности озонокислородной терапии необходимо
исследование в динамике процесса ПОЛ и суммарной АОА методом ИБХЛ плазмы крови.
Отбор больных на лечение озоном должен включать проведение пробной однократной инфузии озонированного физиологического раствора для
исключения индивидуальных реакций.
Литература
1. Азизова О.А., Власова И.И. // Бюлл. экспер. биол. и мед-ны.- 1993.- Т.СХVI.- С.
485-487.
2. Алексеева
Л.М. и др. Влияние озона на некоторые
биохимические системы организма крыс / Озон в биологии и медицине. Н.Новгород:
Тез. докл.
к I Всерос. научно-практ. конф. (25-26 июня 1992г.).-1992.- С. 13.
3. Давиденкова Е.Ф. и др. О взаимосвязи показателей гемокоагуляции и
липидного обмена при атеросклерозе/ Липопротеиды и атеросклероз: Тез. докл. симп.- Спб., 1995.
4. Давиденкова Е.Ф., Шафман М.Г. //
Вестник АМН СССР.- 1989.- N 3.- с.10-18.
5. Каценович Э.Р. и др. // Кардиология.- 1982.- N 3.- С. 76-79.
6. Климов А.Н. Иммунореактивность и атеросклероз.- Л., 1986.- 192 с.
7. Климов А.Н. Эпидемиология и факторы риска ишемической болезни
сердца.- Л.: Медицина, 1989.- С. 174.
8. Коган А.Х. и
др. // Тер. архив.- 1994.- N 4.- С. 32-36.
9. Конторщикова К.Н. Биохимические основы эффективности озонотерапии / Озон в биологии и медицине.- Н.Новгород:
Тез. докл. к II Всерос. научно-практ.
конф. с межд. участием .-сент.-
1995.- С. 8.
10. Кузьмина Е.И.
и др. / В
кн. Биохимия и биофизика микроорганизмов.- Горький,
1983.- С. 41-48.
11. Ланкин В.З. и др. // Вопр. мед. химии.- 1989.- N 3.- С. 18-22.
12. Ланкин В.З., Тихадзе А.К. Обоснование
патогенетической роли свободнорадикального окисления
липидов при атеросклерозе: Симп. "Липопротеиды и
атеросклероз".- СПб., 1995.- С. 52.
13. Масик А.А. и др. Опыт применения озонотерапии
в лечении ишемической болезни сердца / Реабилитация больных с
сердечно-сосудистыми заболеваниями: Тез. докл. II Рос. научно-практ. конф.- М.: ГНИЦ профилакт.мед-ны МЗ РФ,1997.- С.
134-135.
14. Перова Н.В. // Кардиология.- 1996.- N 3.- С. 47-53.
15. Сусеков А.А. // Некоторые аспекты атеросклероза.- 1995.-
Т. 35, N 7.- С. 61-69.
16. Сыркин А.Л. и
др. // Клин мед.- 1996.- N 3.- С.
24-27.
17. Шатилина Л.В. // Кардиология.- 1993.- N 10.- С. 25-28.
18. Fredrickson D.S. et al. // J. Med.-
1967.- Vol. 276.- P. 32-273.
19. Julina N.I. et al. The role of lipid peroxidation in ozone correction of hypoxic impairments.-
Proceedings of 11 Ozone World Congress, San Francisco, 1993.- P. 226-231.
Ozonotherapy
in Multifactor Prpohylaxis of Risk Factors of Ischemic Diseases
E.I.
Sychova
Summary
Received data show
a positiveaction of ozonotherapy
on all links of hemostasis with hypocoagulative
effect, what improves rheological properties of the
blood and is of great importance for pathogenetical
therapy of patients with an ischemic disease.
Key words: ischemic disease, ozonotherapy